-
CO2 和氢氧化钠溶液反应,所得产物中 Na2CO3 和 NaHCO3 物质的量之比为 3 :5 ,则参加反应的 CO2 和NaOH 的物质的量之比为
A. 3 :5 B. 1 : 2 C. 8 : 11 D. 18 : 8
难度: 简单查看答案及解析
-
下列物质性质和应用的对应关系正确的是
A. 84 消毒液具有碱性,可用作消毒剂和漂白剂
B. 氢氟酸具有酸性,可用于玻璃的腐蚀剂
C. 过氧化钠具有漂白性,可作航空和潜水的供氧剂
D. 活性铁粉具有还原性,在食品袋中可用作除氧剂
难度: 简单查看答案及解析
-
下列有关实验操作、现象、解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热
小木条不燃烧
Na2SiO3 可作防
火剂
B
将 H2 在充满Cl2 的集气瓶中燃烧
集气瓶口上方有白烟生成
H2、Cl2 化合生成HCl
C
将 SO2 通入酸性高锰酸钾溶液中
溶液褪色
SO2 具有漂白性
D
除去表面氧化膜的铝箔,在酒精灯上充分加热
铝不能滴落下来
铝熔点高,没能熔化
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
将 3.9 g 镁铝合金投入到 500 mL 2 mol/L 的盐酸中,金属完全溶解,再加入 4mol/L 的NaOH 溶液,若要生成的沉淀最多,加入的这种 NaOH 溶液的体积为
A. 125mL B. 200mL C. 250mL D. 560mL
难度: 简单查看答案及解析
-
已知还原性由强到弱的顺序为 SO3 2- >I ->Br -,向NaBr、NaI、Na2SO3 的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是
A. NaCl B. NaCl、NaBr、Na2SO4
C. NaCl、Na2 SO4、I2 D. NaCl、Na2SO4 、NaI
难度: 中等查看答案及解析
-
化学与社会、生产、生活等密切相关,下列说法正确的是
A. 在“雾霾” 等空气污染的治理方面,化学不能发挥作用
B. 常温下,可以用铁罐贮存浓硝酸,说明铁与浓硝酸不反应
C. 用豆浆可以制作出美味可口的豆腐,运用化学知识可以解释其原理
D. 氯气、明矾是水处理过程中常用的两种化学试剂,两者的作用原理相同
难度: 中等查看答案及解析
-
我国明代《本草纲目》中收载药物 1892 种,其中“烧酒”条目下写道:“自元时始创其法, 用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A. 萃取 B. 蒸馏 C. 过滤 D. 蒸发
难度: 中等查看答案及解析
-
NA 为阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,11.2L 的 SO3 所含分子数为 0.5NA
B. 0.1 mol/L 氢氧化钠溶液中所含 Na+数为 0.1NA
C. 氧原子总数为 0.2NA 的CO2 和 O2 的混合气体,标准状况下其体积为 2.24L
D. 1molFe 与 1molCl2 反应,铁失去电子数为 3NA
难度: 中等查看答案及解析
-
下列离子反应方程式书写正确的是
A. 向 NaAlO2 溶液中通入过量 CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+2Cl-+H2O+4H+
C. 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+
D. 将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
难度: 中等查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的 CO2
②向 Fe(OH)3 胶体中逐滴加入过量 H2SO4
③向 Ba(NO3)2 溶液中通入过量 SO3
④向石灰水中通入过量 CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A. ①②③⑤ B. ①④⑤ C. ①②③ D. ①③⑤
难度: 中等查看答案及解析
-
在下列溶液中,一定能大量共存的离子组是
A. 在强酸性溶液中:Na+、K+、Cl-、HCO3-
B. 加入金属铝有H2 产生的溶液中:Fe2+、Mg2+、NO3-、Cl-
C. 含有大量 Fe3+的溶液中:SCN-、I-、K+、Br-
D. 滴入酚酞变红的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2 四种溶液,不加其他试剂就可鉴别出来, 鉴别的先后顺序是
A. ④③①② B. ③④①② C. ②①③④ D. ④③②①
难度: 中等查看答案及解析
-
对于下列事实的解释不正确的是
A. 因为硅可以导电,所以硅可以作为光导纤维的原料
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
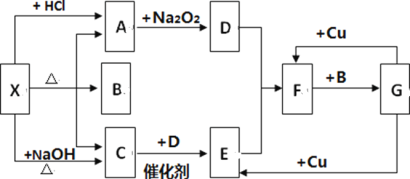
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是


A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化合物中,不能通过化合反应制取的是
A. FeCl3 B. H2SiO3 C. Fe(OH)3 D. FeCl2
难度: 困难查看答案及解析
-
某学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②CO和CO2 都是酸性氧化物;③蔗糖、硫酸钡分别属于非电解质和电解质;④Na2O2和CaO都是碱性氧化物;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦NaCl和KC1可用焰色反应鉴别。上述说法正确的是
A. ①③④ B. ①③⑦ C. ③⑤⑥⑦ D. ①②⑤⑥
难度: 中等查看答案及解析
-
金刚砂(SiC)可由 SiO2 和碳在一定条件下反应制得,在反应方程式为 SiO2+3C
SiC+2CO↑中,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是 SiO2,还原剂为 C
B. 该反应说明了C 的还原性小于SiC
C. 该反应中转移的电子数为 12e-
D. 该反应中的还原产物是 SiC、氧化产物是 CO,其物质的量之比为 1:2
难度: 中等查看答案及解析
-
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入 NaOH 溶液,产生白色沉淀,且产生的沉淀的物质的量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是
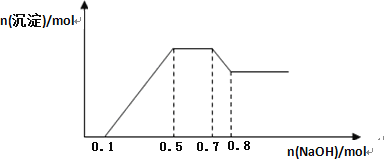
A. 溶液中的阳离子只有 H+、Mg2+、Al3+
B. 溶液中一定不含 CO32-,一定含有SO42-和NO3-
C. 溶液中 n(NH4+)=0.25mol
D. 三种离子的物质的量之比 n(H+):n(Al3+):n(Mg2+)=2:2:1
难度: 中等查看答案及解析