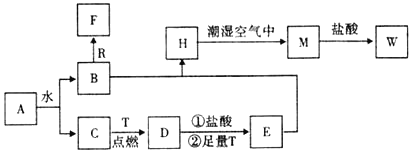
-
有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
难度: 简单查看答案及解析
-
某溶液中只可能溶有Na+、NH4+、SO42-、CO32-、NO3-、Cl-中的几种离子。取200mL该溶液,分为等体积的两份分别做以下实验:
(1)第一份加入足量的烧碱并加热,产生气体在标准状况下的体积为224mL。
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,过滤,得固体2.33g。
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解。
下列说法正确的是
A. 该溶液中可能含有Na+ B. 该溶液中肯定含有NH4+、SO42-、Cl-
C. 该溶液中一定含有Na+ D. 该溶液中一定不含CO32-、NO3-
难度: 中等查看答案及解析
-
某溶液加入铝可以产生H2,则在该溶液中可能大量存在的离子组是
A. Na+、Fe3+、SO42-、SCN- B. K+ 、Na+、AlO2-、Cl-
C. K+ 、Na+、I-、MnO4- D. Na+、K+、HCO3-、Cl-
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “时气错逆,霾雾蔽日”,雾所形成的气溶胶能产生丁达尔效应
B. “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化
C. “熬胆矾铁釜,久之亦化为铜”,北宋沈括用胆矾炼铜的过程属于置换反应
D. “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应
难度: 简单查看答案及解析
-
一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球②中装的是O2
B. 气球①和气球③中气体分子数相等
C. 气球③和气球④中气体密度之比为2∶1
D. 气球①和气球④中气体物质的量之比为4∶1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 1L 1mol/L的盐酸中含有HCl分子数为NA
B. 8.8g由CO2和N2O组成的混合气体中含有的原子总数为0.3NA
C. 标准状况下,11.2LSO3所含的分子数为0.5NA
D. Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列实验操作所用仪器合理的是
A. 实验室配制480mL 1mol.L-1的NaOH溶液,需称量19.2g固体NaOH
B. 将CCl4与溴水混合后振荡、静置,再用分液漏斗分离得到溴的四氯化碳溶液
C. 用托盘天平称取25.30gNaCl固体
D. 用50mL量筒量取4.8mL硫酸
难度: 中等查看答案及解析
-
下列根据实验操作得出的结论正确的是
操作
现象
结论
A
无色溶液先滴加BaCl2溶液后加稀盐酸
生成白色沉淀不溶于盐酸
原溶液中一定有SO42-
B
无色溶液依次滴加氯水和CCl4,振荡、静置
下层溶液显橙红色
原溶液中有Br―
C
新制氯水滴在蓝色石蕊试纸上
试纸先变红色后褪色
Cl2有漂白性
D
无色溶液滴加稀盐酸,产生无色无味气体,将气体通入澄清石灰水中
生成白色沉淀
原溶液中有大量CO32—
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A. 澄清的石灰水跟盐酸反应:H++OH-= H2O
B. 氯气与水反应:Cl2+H2O = 2H++Cl-+ClO-
C. 碳酸钡与稀盐酸反应:CO32-+2H+ = H2O+CO2↑
D. 金属钠跟水反应:Na+H2O = Na++OH-+H2↑
难度: 中等查看答案及解析
-
下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是
① NaHCO3 ② Al2O3 ③ NaAlO2 ④ Al ⑤(NH4)2CO3 ⑥ AlCl3 ⑦ Al(OH)3
A. ① ② ③ ④ ⑥ B. ① ② ④ ⑤ ⑦
C. ① ③ ④ ⑤ ⑦ D. ① ② ⑤ ⑥ ⑦
难度: 中等查看答案及解析
-
实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是
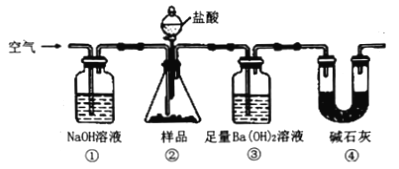
A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
难度: 中等查看答案及解析
-
下列测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的实验方案,合理的是
① 取a g混合物与过量氢氧化钠溶液充分反应,加热、蒸干、灼烧,得b g固体
② 取a g混合物充分加热,减重bg
③ 取a g混合物与过量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
④ 取a g混合物与过量Ba(OH)2溶液充分反应,过滤、洗涤、干燥,得b g固体
A. ① ② B. ② ③ C. ② ④ D. ③ ④
难度: 中等查看答案及解析
-
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,下列说法不正确的是
A. Cl2既是氧化产物,又是还原产物
B. 转移5mol电子时,产生67.2L的Cl2
C. 盐酸既体现酸性,又体现还原性
D. 被氧化的元素和被还原的元素的质量之比5:1
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
A. 向Ca(ClO)2溶液中通入CO2至过量
B. 向Na2SiO3溶液中滴加盐酸溶液至过量
C. 向NaAlO2溶液中逐滴加入过量的稀盐酸
D. 向Fe(OH)3胶体中逐滴加入过量的稀盐酸
难度: 中等查看答案及解析
-
m molCu2S与足量的稀硝酸反应,生成Cu(NO3)2、H2SO4、NO和H2O。则被还原的HNO3的物质的量为
A. 4m mol B. 2m/3mol C. 10m mol D. 10m/3 mol
难度: 困难查看答案及解析
-
将0.01molNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
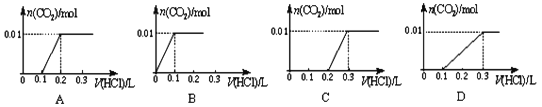
A. A B. B C. C D. D
难度: 中等查看答案及解析