-
有关下列图象的说法正确的是( )
A. 表示的反应速率随温度变化的关系可知该反应的△H>0
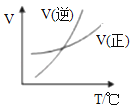
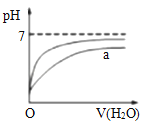
B. 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸
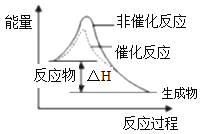
C. 表示该反应为放热反应,且催化剂能降低反应的活化能、改变反应的焓变
D. 中开关K置于a或b处均可减缓铁的腐蚀

难度: 中等查看答案及解析
-
表示氢气燃烧热的是( )
A. H2(g)+
O2(g)=H2O(g)△H=﹣241.8 kJ/mol
B. 2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ/mol
C. H2(g)+
O2(g)=H2O(l)△H=﹣285.8 kJ/mol
D. 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ/mol
难度: 简单查看答案及解析
-
下列属于放热反应的是( )
A. 浓硫酸的稀释 B. 铝热反应
C. 氢气还原氧化铜 D. Ba(OH)2•2H2O和NH4Cl(固体)混合
难度: 简单查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。已知:①S(单斜,s)+O2(g)═SO2(g)△H1=﹣297.16kJ/mol;②S(正交,s)+O2(g)═SO2(g)△H2=﹣296.83kJ/mol;③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
A. △H3=+0.33 kJ/mol
B. 单斜硫转化为正交硫的反应是吸热反应
C. S(单斜,s)═S(正交,s)△H3<0,正交硫比单斜硫稳定
D. S(单斜,s)═S(正交,s)△H3>0,单斜硫比正交硫稳定
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)
2C(g),可以判断达到化学平衡状态的是( )
A. 体系压强不变 B. 单位时间消耗n molA,同时生成2nmolC
C. A的转化率不变 D. 容器内气体密度不变
难度: 简单查看答案及解析
-
下列说法正确的是
A. 分子式为C4H10O的有机化合物一定是饱和一元醇
B. 1molCl2通入足量水充分反应后转移的电子数为6.02×1023
C. H2O2具有氧化性,该性质可用于与酸性高锰酸钾溶液反应制取少量氧气
D. 已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为CuSO4•5H2O(s)═CuSO4(s)+5H2O(l)△H=+Q1kJ•mol-1.室温下,若1mol无水硫酸铜溶解为溶液放热Q2kJ,则Q1>Q2
难度: 中等查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为( )
A. -1780kJ/mol B. -1220 kJ/mol C. -450 kJ/mol D. +430 kJ/mol
难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH (l)+2O2 (g) == 2CO2 (g)+2H2O (l) ΔH1=-870.3 kJ·mol-1
(2)C (s)+ O2 (g) == CO2 (g) △H2=-393.5 kJ•mol-1
(3)H2(g) +
O2(g) == H2O (l) △H3=-285.8kJ·mol-1
则反应2C (s)+2H2 (g) +O2 (g) == CH3COOH (l)的△H为
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
难度: 中等查看答案及解析
-
已知:C(s,金刚石)=C(s,石墨) △H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A. △H1=△H2 B. △H1>△H2
C. △H1<△H2 D. 金刚石比石墨稳定
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g)ΔH<0,下列图象正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
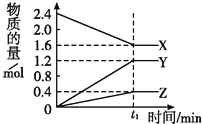
现有X(g)+Y(g)
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的( )
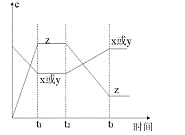
A. 增大X或Y的浓度
B. 增大压强
C. 增大Z的浓度
D. 升高温度
难度: 困难查看答案及解析
-
已知:2SO2(g)+O2(g)=2SO3(g) △H,有关数据如下:

下列说法不正确的是( )
A.根据平衡常数随温度的变化关系,判断出△H<0
B.保持其他条件不变,SO2的平衡转化率a(727℃)<a(927℃)
C.增大压强、降低温度能提高SO2的转化率
D.SO3的稳定性随温度的升高而降低
难度: 中等查看答案及解析
-
(l)
=H2O(g) △H1=a kJ·
(2)
=2H2O(g) △H2=b kJ·
(3)
=H2O(l) △H3=c kJ·
(4)
=2H2O(l) △H4=d kJ·
下列关系式中正确的是( )
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
难度: 中等查看答案及解析
-
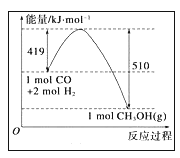
已知HI在催化剂作用下分解速率会加快,其能量随反应进程的变化如图所示。下列说法正确的是
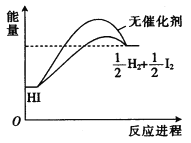
A.加入催化剂,减小了反应的活化能 B.加入催化剂,可提高HI的平衡转化率
C.降低温度,HI的分解速率加快 D.反应物的总能量大于生成物的总能量
难度: 中等查看答案及解析
-
已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ/mol P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ/mol P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。 下列叙述正确的是 ( )
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H
C. Cl-Cl键的键能为
kJ/mol
D. P-P键的键能为
kJ/mol
难度: 中等查看答案及解析
-
关于中和热的测定实验,下列说法正确的是 ( )
A.为了使反应进行的更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关
D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大
难度: 简单查看答案及解析
-
向一密闭容器中充入1 mol N2和3 mol H2, 在一定条件下反应。下列叙述中,能说明上述反应达到化学平衡状态的是( )
A. 容器内混合气体的密度不随时间的变化而变化
B. 混合气体的总物质的量不随时间的变化而变化
C. 混合气体的总质量不随时间的变化而变化
D. 单位时间内每消耗3mol H2,同时生成2mol NH3
难度: 困难查看答案及解析
-
下列说法正确的是
A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为
—285.8kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq) + OH--(aq) === H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
难度: 中等查看答案及解析
-
一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min
n(CO)/mol
n(H2O)/mol
n(CO2)/mol
n(H2)/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A. 已知甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
B. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知中和热为△H=-57.4kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
难度: 中等查看答案及解析
-
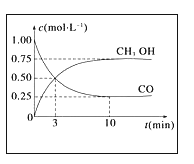
在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)
CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )

A. △H1<0,△H2>0
B. 增大压强有利于加快合成反应的速率
C. 生产过程中,温度越高越有利于提高CH3OH的产率
D. 合成CH3OH反应的平衡常数表达式是K=
难度: 中等查看答案及解析
-
H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( )
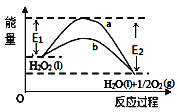
A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l)═H2O(l)+
O2(g)△H=﹣(E1﹣E2)kJ/mol
难度: 中等查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度
甲
乙
丙
c(H2)/(mol/L)
0.010
0.020
0.020
c(CO2)(/mol/L)
0.010
0.010
0.020
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 中等查看答案及解析
-
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )

A. 2SO2(g)+O2(g)
2SO3(g) ΔH<0
B. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
C. H2(g)+I2(g)
2HI(g) ΔH>0
D. 2NH3(g)
N2(g)+3H2(g) ΔH>0
难度: 中等查看答案及解析
-
把0.6 mol X气体和0.6 mol Y气体混合于2L的密闭容器中,使它们发生如下反应3X(g)+Y(g)
nZ(g)+2W(g)。5 min末生成0.2 mol W。若测知以Z的浓度变化表示平均反应速率为0.01 mol·L-1·min-1,则化学方程式中的值为
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析