-
用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 贮氢金属并不是简单地吸附氢气,而是通过化学方法贮存氢气
B. 在高温下煤和水蒸气作用得到CO、H2、CH4等气体的方法属于煤的气化
C. 纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D. 氢能、核能、太阳能是洁净、高效的新能源
难度: 中等查看答案及解析
-
碳酸亚乙酯是一种重要的添加剂,结构如图(
),碳酸亚乙酯可由环氧乙烷与二氧化碳反应而得,亦可由碳酸与乙二醇反应获得。下列说法正确的是
A. 上述两种制备反应类型相同
B. 碳酸亚乙酯的分子式为C3H6O3
C. 碳酸亚乙酯保存时应避免与碱接触
D. 碳酸亚乙酯中所有原子可能共平面
难度: 中等查看答案及解析
-
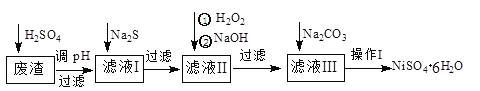
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
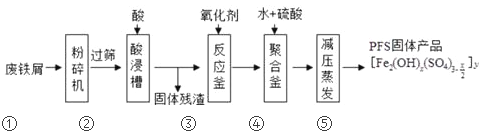
下列说法不正确的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
C. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
D. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
难度: 中等查看答案及解析
-
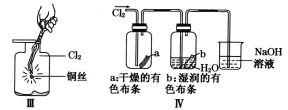
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
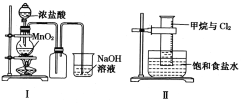
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
难度: 中等查看答案及解析
-
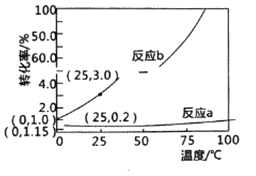
第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
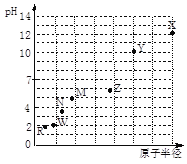
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
难度: 中等查看答案及解析
-
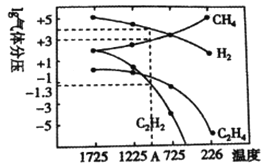
高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
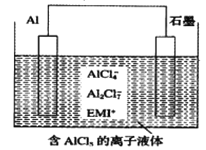
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) △H1=a kJ·mol-1
②3AlCl(g)===2A1(1)+AlCl3(g) △H2=b kJ·mol-1
③Al2O3(s)+3C(s)===2A1(1)+3CO(g) △H3
下列说法正确的是
A. 该电池放电时的负极反应方程式为A1-3e-+7AlCl4-===4A12C17-
B. ΔH2<0
C. 该电池充电时石墨电极与电源负极相连
D. A12O3(s)+3C(s)===2A1(1)+3CO(g) ΔH3=(a-b) kJ·mol-1
难度: 中等查看答案及解析

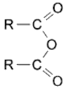 +R’NH2
+R’NH2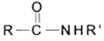 +RCOOH
+RCOOH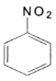
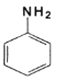
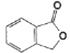 的流程图(无机试剂任选)_________________。
的流程图(无机试剂任选)_________________。