-
下列与化学有关的说法中错误的是
A.侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异
B.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容
C.石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化
D.合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb—Ti)合金,它的熔点一般比纯钛要低
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 0.3 mol·L-1A1(NO3)3溶液中含A13+数小于0.3 NA
B. H2(g)+I2(g)
2HI(g) △H= - akJ·mol-1,向密闭容器中加入NA个氢分子和NA个碘分子,充分反应后放出的热量为akJ
C. 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
D. 标准状况下, Zn│H2SO4(1mol·L-1)│Cu原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
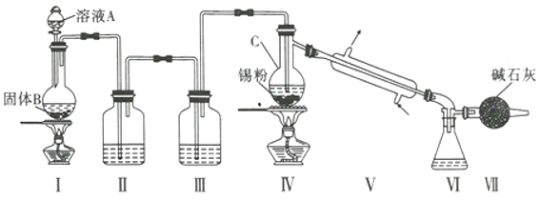
下列制取Cl2并用其氧化含I-废液,回收提纯I2的装置和原理能达到实验目的的是( )
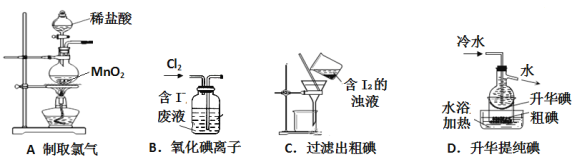
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期元素,W是原子半径最小的短周期元素,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍,下列说法中不正确的是( )
A. 由W和X两种元素形成的化合物可能含有非极性共价键
B. 由X、Y、Z三种元素形成的化合物只能为Y2ZX3或Y2ZX4
C. 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性
D. W、X、Y、Z四种元素两两之间均可形成二元化合物
难度: 中等查看答案及解析
-
常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
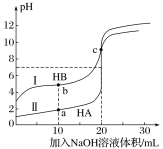
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
难度: 困难查看答案及解析
-
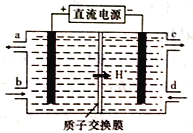
LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
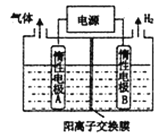
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法不正确的是( )
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,升高温度,反应达到新平衡前v(正)<v(逆)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 困难查看答案及解析
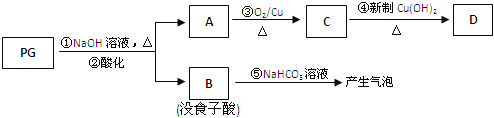
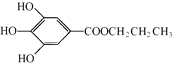 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.