-
高科技材料与生活、生产、科技密切相关。下列有关重点发展的科技材料说法错误的是
A. 用于“天宫二号”的纳米陶瓷铝合金硬度大、强度高
B. 生物塑料可减少白色污染
C. 高性能分离膜可用于海水淡化
D. 用于3D打印材料的光敏树酯是纯净物
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(
)是其中的一种。下列关于该化合物的说法不正确的是
A. 与环庚烯互为同分异构体 B. 二氯代物共有6种(不含立体异构)
C. 所有碳原子不可能处在同一平面 D. 1mol该化合物含有20mol共价键
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 标准状态下560mL的氢气和氯气混合充分反应后共价键数目为0.05NA
B. 标准状态下,将50mL0.01mol/L的NH4Cl溶液与等体积等浓度的NaOH溶液混合,产生气体的分子数为5×10-4NA
C. 常温常压下,1.5 mol HCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D. 0. 1 mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D. W、X、Q三种元素都能形成多种氧化物
难度: 中等查看答案及解析
-
下列由实验得出的结论不正确的是
选项
实验
结论
A
取一小块鸡皮置于蒸发皿中,滴35滴浓硝酸并在酒精灯上微热,变黄
说明鸡皮中含有蛋白质
B
将带火星的木条伸入盛有体积比为4︰1的NO2与O2的混合气体中,木条复燃
说明NO2具有氧化性能作助燃剂
C
将石蜡油蒸气依次通过加热的内含碎瓷片的玻璃管、盛有酸性高锰酸钾溶液的洗气瓶,高锰酸钾溶液褪色
说明石蜡油中含有不饱和键的烃
D
将已烯加入溴水中,测溴水层溶液前后的pH值,结果pH值没有变小
说明已烯与溴发生了加成反应,不是取代反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
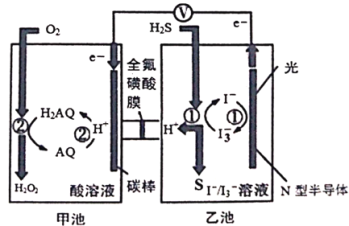
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
难度: 中等查看答案及解析
-
25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关
、
系如图中M或N线所示。下列叙述正确的是

A. M线表示
随pH的变化 B. 若温度升高,两条线均往上平移
C. BR溶液呈碱性 D. 25℃,0.1 mol/L NaR溶液的pH约为10
难度: 困难查看答案及解析

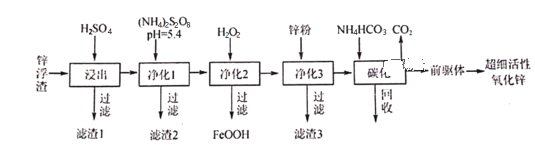
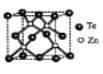
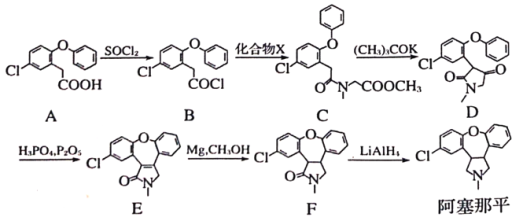
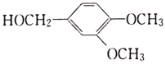 为原料制备
为原料制备 的合成流程(无机试剂任用)______________________。
的合成流程(无机试剂任用)______________________。