-
化学与人类活动密切相关,下列有关说法正确的是
A. 加酶洗衣粉可以很好的洗涤毛织品上的污渍
B. 从花生中提取的生物柴油与由石油炼得的柴油都属于烃类物质
C. 用石灰水或 MgSO4溶液喷涂在树干上均可消灭树皮上的过冬虫卵
D. 含氟牙膏能抑制口腔细菌产生酸,在一定程度上能防止或减少龋齿
难度: 简单查看答案及解析
-
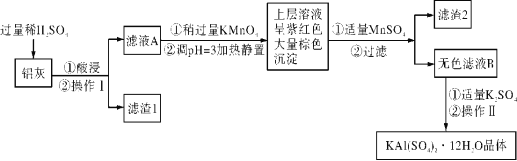
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
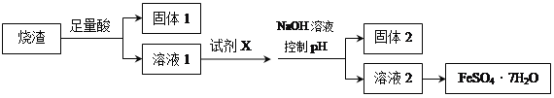
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
下列实验操作、现象及得出的结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
Cu与浓硫酸反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中
溶液变蓝
证明反应生成了Cu2+
B
向KNO3和KOH混合溶液中加入铝粉并加热,管口放置湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液
产生黑色沉淀(Ag2S)
Ksp(Ag2S) >Ksp(Ag2CO3)
D
铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中
铝丝表明变红色
铝可以从铜盐溶液中置换出铜
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中阳离子的数目相等
B. 将2molSO2气体与1molO2混合后在一定条件下充分反应,所得SO3的分子数为2NA
C. 精炼铜,若阳极失去0.1NA个电子,则阴极增重3.2g
D. 标准状况下,22.4LHF所含有的分子数目为NA
难度: 中等查看答案及解析
-
已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子。它们之间转化关系如下图所示。下列说法正确的是
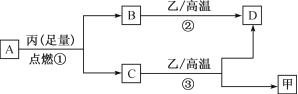
A. 原子半径:Z>Y>X
B. 稳定性:A>C
C. 反应②和③均为吸热反应
D. X、Y、Z可以形成离子化合物
难度: 困难查看答案及解析
-
通过电解法分离NaHSO3与Na2SO3混合物,其装置如下图。下列说法不正确的是
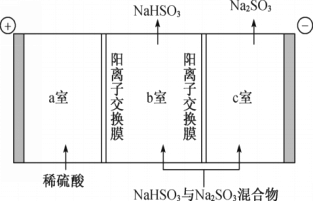
A. 阳极的电极反应式为4OH--4e-==2H2O+O2↑
B. 阳极区c(H+)增大,H+由a室经阳离子交换膜进入b室
C. 外电路每转移0.2 mol电子,有0.2 mol Na+从b室进入c室
D. c室得到Na2SO3的原因是OH-+HSO3- = H2O+SO32-
难度: 中等查看答案及解析
-
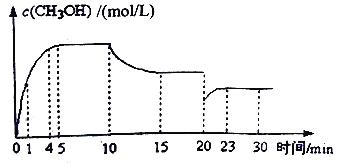
298K(25℃)下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述正确的是
已知:(1)在科学计数法中,为了使公式简便,可以用带“E”的格式表示,例如:1E-4=1×10-4。
(2)298K(25℃)下H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
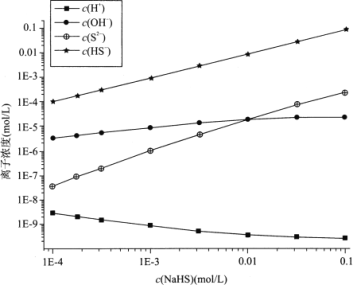
A. 0.10mol/LNaHS溶液:c(Na+)>c(HS-)>c(OH-)>c(S2-)
B. Na2S溶液中:c(OH-)-c(H+)=c(H2S)+c(HS-)
C. 当c(OH-)=c(S2-)时,c(HS-)=9.09×10-3
D. 室温下用NaOH溶液滴定NaHS溶液,滴定终点刚好形成0.1mol/LNa2S溶液,该过程可选择酚酞作指示剂
难度: 中等查看答案及解析
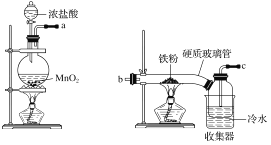
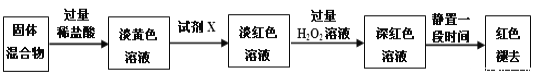

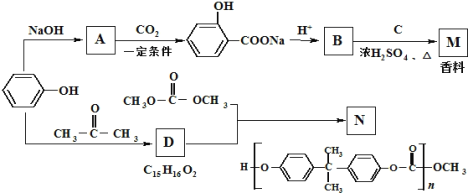
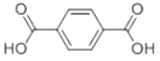 ,则符合下列条件的F的同分异构体有 ______种。
,则符合下列条件的F的同分异构体有 ______种。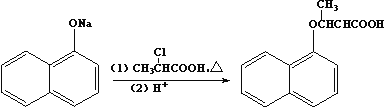 ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备