-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.4gMg在空气中完全燃烧,转移电子数一定为0.2NA
B. 标准状况下,2.24L HF中所含原子总数一定为0.2NA
C. 5.6gFe在稀硝酸中完全溶解,转移电子数一定为0.2NA
D. 12.0g熔融的NaHSO4中,阳离子的总数一定为0.2NA
难度: 中等查看答案及解析
-
“一带路(OneBelt AndOneRoad)”构建人类命运共同体,符合国际社会的根本利益,彰显著人类社会的共同理想和关好追求。下列贸易的商品中,其主要成分属于无机物的是
A. 中国丝绸 B. 埃及长绒棉 C. 乌克兰葵花籽油 D. 捷克水晶
难度: 中等查看答案及解析
-
二羟甲戊酸是生物合成青蒿素的原料之一,其结构如图所示。下列关于二羟甲戊酸的说法正确的是
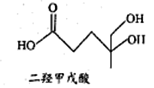
A. 分子式为C3H14O4
B. 能使酸性KMnO4溶液褪色
C. 能发生加成反应,不能发生取代反应
D. 1mol该有机物与足量金属钠反应产生22.4L H2
难度: 中等查看答案及解析
-
常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的是
A. pH=3的草酸溶液含有H+数目为0.001NA
B. 当1molKMnO4被还原时强酸提供H+数目为NA
C. 1molHOOC-COOH含共用电子对数目为9NA
D. 该反应释放CO2分子数目为
难度: 中等查看答案及解析
-
利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)
选项
实验目的
甲
乙
丙
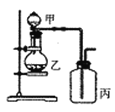
A
证明浓硫酸具有强氧化性
浓硫酸
碳粉
溴水
B
验证Cl2无漂白性
浓盐酸
MnO2
干燥的红色布条
C
验证NH3溶于水显碱性
浓氨水
碱石灰
湿润的蓝色石蕊试纸
D
比较H2CO3和H2SiO3的酸性
硼酸溶液
碳酸钠
硅酸钠溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是
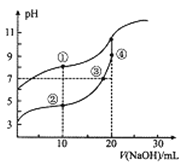
A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
难度: 中等查看答案及解析



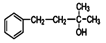 )的合成路线。
)的合成路线。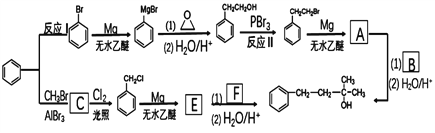
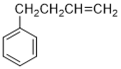 )的合成路线:____
)的合成路线:____