-
化学与生活息息相关,下列有关说法错误的是
A. “光化学烟雾”的形成与汽车排放的不合格尾气有关
B. 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
C. “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
D. 页岩气是从页岩层中开采出来的天然气,可以成为廉价而充足的清洁燃料来源
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 3g甲酸与乙醛的混合物中含有共价键数为0.4NA
B. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
C. 将标准状况下2.24LSO2通入水中完全溶解,溶液中H2SO3分子数为0.1NA
D. 标准状况下8.96L的平均相对分子质量为3.5的H2与D2含有中子数0.3NA
难度: 中等查看答案及解析
-
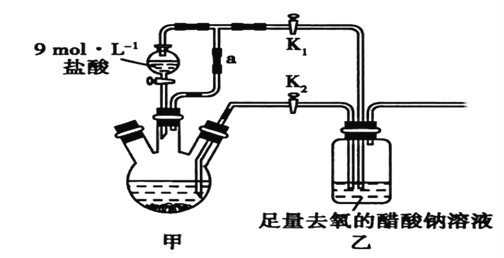
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
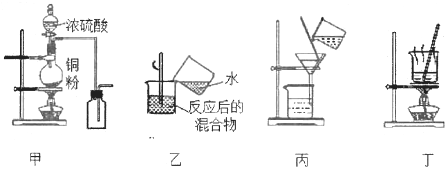
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法错误的是

A. a与
互为同分异构体
B. b中所有的碳原子不可能处于同一平面
C. b生成1mol
至少需要3molH2
D. a中六元环上的一氯代物共有5种(不考虑立体异构)
难度: 中等查看答案及解析
-
短周期主族元素Ⅹ、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍。下列有关这四种元素的相关叙述正确的是
A. 只有Y元素存在同素异形体
B. X与Z形成的离子化合物溶于水,溶液呈碱性
C. R的氢化物比Y的氢化物的沸点更高
D. X、Y、Z、R形成简单离子的半径依次增大
难度: 中等查看答案及解析
-
某温度下,将1.1mol I2加入到氢氧化钾溶液中,反应后得到KI、KIO、KIO3的混合溶液。经测定IO-与IO3-的物质的量之比是2:3。下列说法错误的是
A. I2在该反应中既作氧化剂又作还原剂
B. 该反应中转移电子的物质的量为1.7mol
C. 该反应中,I2的还原性大于KIO和KI03的还原性
D. 该反应中,被还原的碘元素与被氧化的碘元素的物质的量之比是5:17
难度: 中等查看答案及解析
-
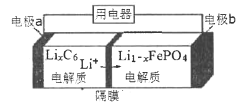
已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是
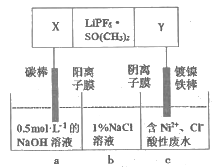
A. 电极Y应为Li
B. X极反应式为FeS+2Li++2e-=Fe+Li2S
C. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析

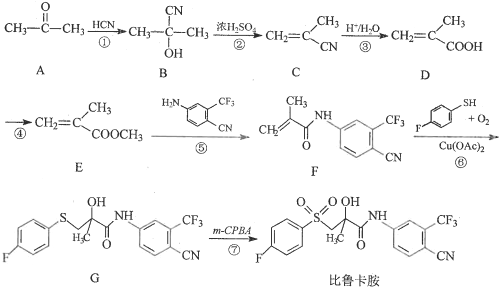
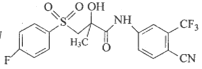 ),是一种具有抗癌活性的药物分子,其中一条合成路线如下:
),是一种具有抗癌活性的药物分子,其中一条合成路线如下: