-
化学与人类的生活、生产密切相关。下列说法正确的是( )
A. 人工分子筛( 多孔铝硅酸盐) 可以用作吸附剂和催化剂
B. 埃博拉病毒可用乙醇、次氯酸钠溶液或双氧水消毒,其消毒原理相同
C. 纯碱属于碱类、谷氨酸钠(C5H8NO4Na,味精)属于盐类
D. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 以淀粉为主要原料可制取乙酸乙酯
B. 用氢氧化钠溶液无法鉴别矿物油和植物油
C. 某烷烃的二氯代物有3 种,则该烃的分子中碳原子个数可能是4
D. 乙烯、乙炔、乙醇、乙醛、葡萄糖都能与酸性的KMnO4或K2Cr4O7溶液反应
难度: 困难查看答案及解析
-
设NA 为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 乙烯和丙烯组成的42 g 混合气体中碳氢键数目为6NA
B. 标准状兄下,22.4 L二氯甲烷的分子数约为NA
C. 常温常压下,1mol 甲醇完全燃烧生成CO2 和H2O,转移的电子数目为12NA
D. 将1molCH3COONa 溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于NA
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
难度: 中等查看答案及解析
-
某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
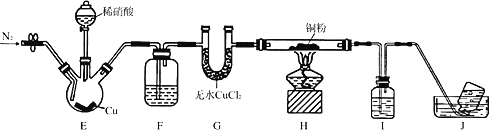
已知:在溶液中,FeSO4+NO
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
A. 装置F、I中的试剂依次为水,硫酸亚铁溶液
B. 装置J收集的气体中不含NO
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
难度: 中等查看答案及解析
-
锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
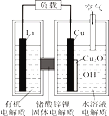
A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
难度: 困难查看答案及解析
-
用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
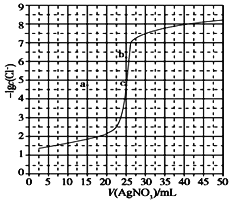
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
难度: 困难查看答案及解析


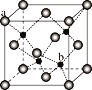
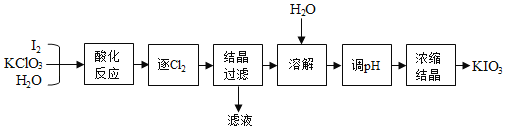
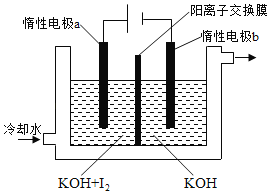
 )的合成路线。
)的合成路线。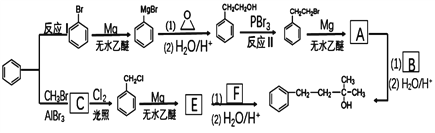
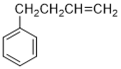 )的合成路线:____
)的合成路线:____