-
化学与生产、生活密切相关,下列有关说法正确的是
A. 淀粉与纤维素互为同分异构体
B. 煤的气化、液化与石油的裂化、裂解均为化学变化
C. 被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D. 糖类、油脂和蛋白质都属于营养物质,都能发生水解反应
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液。下列说法正确的是
A. 元素Y的最高正化合价为+6 B. 简单离子半径的大小顺序:X>Y>Z
C. 简单气态氢化物的稳定性:X>Y D. 元素X和Y能形成离子化合物
难度: 中等查看答案及解析
-
将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
A. 该实验表明SO2有漂白性 B. 白色沉淀为BaSO3
C. 该实验表明FeCl3有还原性 D. 反应后溶液酸性增强
难度: 中等查看答案及解析
-
下列关于化学用语的表示正确的是
A. 质子数为8、质量数为17的原子:
B.
的电子式:

C. 氯离子的结构示意图:

D. 对硝基甲苯的结构简式:

难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 60g SiO2晶体中含有4NA个硅氧键
B. 1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数为0.1NA
D. K35ClO3与浓H37Cl反应制得7.2g Cl2,则生成的Cl2分子数为0.1NA
难度: 困难查看答案及解析
-
下列关于维生素C(
 )的说法错误的是( )
)的说法错误的是( )A. 维生素C 可以发生加成反应
B. 维生素C 可以与金属Na发生置换反应
C. 维生素C具有还原性,只能发生氧化反应
D. 维生素C 可以与NaOH 溶液发生取代反应.
难度: 中等查看答案及解析
-
利用图示装置进行下列实验,能达到实验目的的是
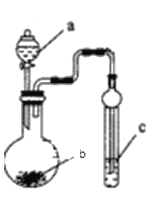
溶液a
固体b
溶液c
实验目的:验证
A
浓硝酸
NaHCO3
Na2SiO3
非金属性:N>C>Si
B
浓盐酸
KMnO4
Na2S
氧化性:KMnO4>Cl2>S
C
浓盐酸
CaCO3
NaAlO2
酸性:HCl>H2CO3>Al(OH)3
D
浓氨水
CaO
酚酞溶液
NH3·H2O是弱碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是( )
A. 在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN-
B. c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、
、
C. 加水稀释时
值增大的溶液中可大量存在:
、
、
、
D. 在碱性溶液中可以大量存在:
、AlO2-、
、
、
难度: 中等查看答案及解析
-
能正确表示下列反应离子方程式的是
A. 向Na2CO3溶液中滴入AgNO3溶液:2Ag++CO32-=Ag2CO3↓
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
D. 用惰性电极电解熔融氯化钠:2Cl-+2H2O=Cl2+H2+2OH-
难度: 中等查看答案及解析
-
—种以Na2SO4为电解质的钠离子电池的总反应如下,下列有关说法正确的是
NaTi2(PO4)3+Zn+Na2SO4
Na3Ti2(PO4)3+ZnSO4
A. 放电时,NaTi2(PO4)3发生氧化反应 B. 放电时,Na+向锌电极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]-+2e-
[Ti2(PO4)3]3- D. 充电时,每转移0.2mol电子,理论上阴极增重6.5g
难度: 困难查看答案及解析
-
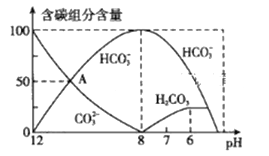
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述中正确的是
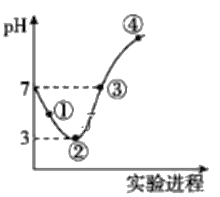
A. 曲线③④段有离子反应:HClO+OH-=ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯水与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
难度: 中等查看答案及解析
-
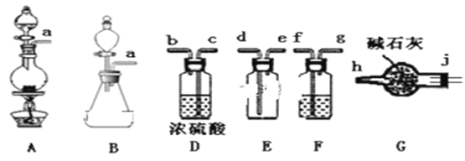
下列装置能达到相应实验目的的是
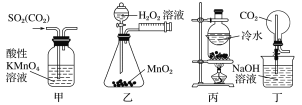
A.甲装置,除去SO2中混有的CO2
B.乙装置,测定O2的生成速率
C.丙装置,分离NH4Cl和Ca(OH)2固体
D.丁装置,做喷泉实验
难度: 中等查看答案及解析
-
下列说法不正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b
B.常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性
D.物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>②
难度: 中等查看答案及解析
-
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是
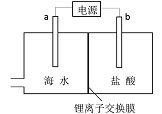
A. a连接电源的正极
B. Li+的移动方向是从海水进入到盐酸中
C. 一段时间后,b电极附近溶液的pH降低
D. 电解过程中还可能获得有经济价值的副产物氢气和氯气
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA
B. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA
C. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
难度: 中等查看答案及解析
-
下列各组物质按右图所示转化关系每一步都能一步实现的是( )
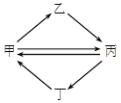
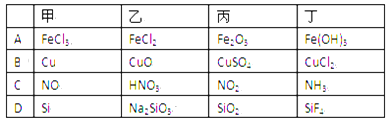
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
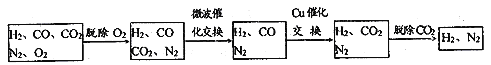
常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是( )
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
难度: 中等查看答案及解析
-
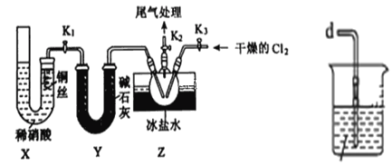
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是

A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
难度: 中等查看答案及解析