-
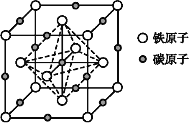
短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是
A. 离子半径: W<Y<Z
B. 工业上采用电解Y 的氧化物冶炼单质Y
C. W、X元素组成的化合物一定只含离子键
D. W、X、Z三种元素组成的化合物的水溶液可能显碱性
难度: 中等查看答案及解析
-
化学与人类生产、生活密切相关,下列叙述中不正确的是
A. 从花生中提取的生物柴油和从石油炼得的柴油都属于烃类物质
B. “光化学烟雾”、“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关
C. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料
D. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,3.2 g 14C18O中含中子数为1.4NA
B. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
难度: 困难查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI
溶液变蓝色
氧化性:IO3- >I2
B
淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸
无红色沉淀生成
淀粉没有水解
C
常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞
两份溶液均变红,NaHCO3溶液红色更深
常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-)
D
常温时,用两支试管各取5 mL 0.1 mol/L 酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL
两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快
其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是
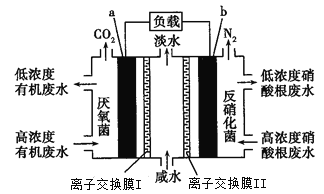
A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
难度: 困难查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A. 向0.1 mol·L−1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(
)+c(
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(
)−c(H2SO3)=9.9×10−7 mol·L−1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:
<
D. 0.1 mol·L−1 Na2C2O4溶液与0.1 mol·L−1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(
)+c(
)+c(OH−)=c(Na+)+c(H+)
难度: 中等查看答案及解析

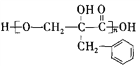 )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下: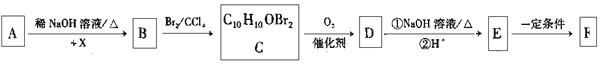
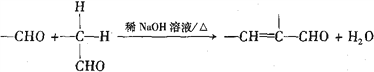
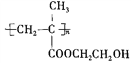 )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。