-
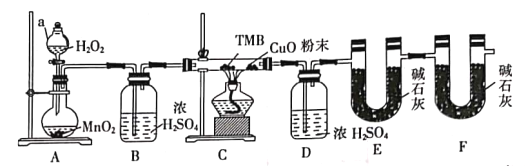
某城市主要空气污染物为PM2.5、SO2、NOx。科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
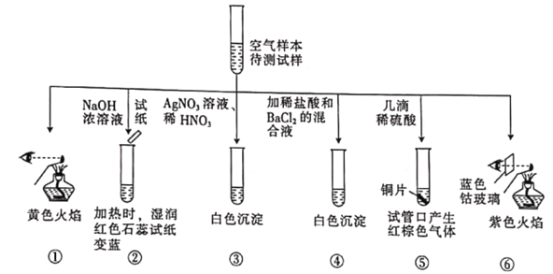
下列判断不正确的是
A. 上述实验中可用Ba(NO3)2代替BaCl2,以证明待测试样中含SO42-
B. 由实验②⑤可知待测试样中含有NH4+和NO3-
C. 焰色反应表明待测试样中含Na元素和K元素
D. 该城市的污染来源主要是燃煤和机动车尾气排放
难度: 中等查看答案及解析
-
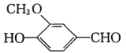
羟甲香豆素(
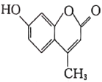 )是一种治疗胆结石的药物,下列说法正确的是
)是一种治疗胆结石的药物,下列说法正确的是A. 分子中的两个苯环都可以发生加成反应
B. 所有原子均处于同一平面
C. 1mol羟甲香豆素与氢气加成,最多需要5molH2
D. 二氯代物超过两种
难度: 中等查看答案及解析
-
用下列装置完成相应的实验,能达到实验目的的是
A.
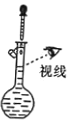 配制一定浓度的氯化钠溶液
配制一定浓度的氯化钠溶液B.
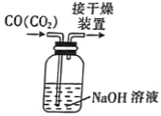 除去CO中的CO2
除去CO中的CO2C.
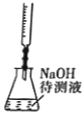 中和滴定
中和滴定D.
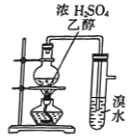 制取并检验乙烯
制取并检验乙烯难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,下列叙述正确的是
A. 1L0.1mol·L-1Na2S溶液中含有的S2-的数目小于0.1NA
B. 同温同压下,体积均为22.4L的卤素单质中所含的原子数均为2NA
C. 1mol苯中含有的碳碳双键数为3NA
D. 78g过氧化钠固体中所含的阴、阳离子总数为4NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Ⅹ、Z最外层电子数之和为13,W与Y同族,W的单质在Z的单质中点燃可以安静地燃烧,火焰为苍白色,且伴有白雾生成。下列说法不正确的是
A. 常温常压下X的单质为气态
B. Y与其他三种元素均可形成离子化合物
C. Y和Z形成的化合物的水溶液呈碱性
D. W与Z具有相同的最低化合价
难度: 中等查看答案及解析
-
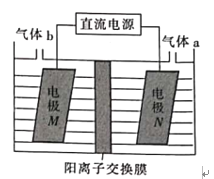
利用如图所示装置可制备LiOH,两电极区电解液分别为LiCl溶液和LiOH溶液。下列说法错误的是
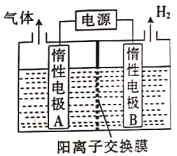
A. B极区的电极反应式2H2O+2e-=H2↑+2OH-
B. A极的电势一定比B极的高
C. 实际电解过程中A极区pH减小
D. 若改为阴离子交换膜,则两极气体产物仍相同
难度: 中等查看答案及解析
-
常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
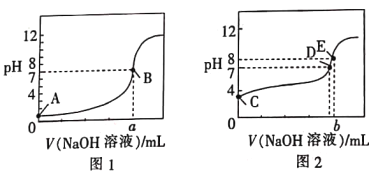
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
难度: 中等查看答案及解析
 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下: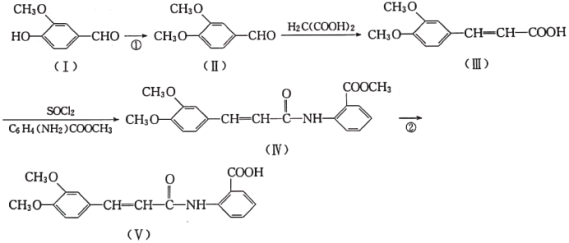
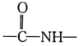 (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。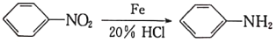 ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(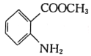 )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。