-
下图所示为海水综合利用的部分流程,下列有关说法正确的是

A. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质加入的药品顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 第②步是一个将电能转化为化学能的过程,工业上可采用石墨为电极,采用阴离子交换膜的电解装置
C. 第③步中结晶出的MgC12·6H2O可在空气中受热分解制无水MgC12
D. 第④步中反应的离子方程式为C12+2Br-=2C1-+Br2,第④⑤步的目的是富集溴元素
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 60gSiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键
B. H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
C. 1L0.2mo1/ LNaHCO3溶液中含HCO3-和CO32-的离子数之和为0.2NA
D. 足量的Mg与稀H2SO4完全反应,生成2.24LH2时,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
对于下列实验描述正确的是

A. 图1:左边棉花变为橙色,右边棉花变为蓝色,还原性:C1-<Br-<I-
B. 图2:酸性KMnO4溶液中出现气泡,但颜色无变化
C. 图3:可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
D. 图4:试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>ksp(Ag2S)
难度: 困难查看答案及解析
-
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的气态化合物在水中呈碱性,C和E形成化合物CE。下列说法正确的是
A. B、C、D、E四种元素简单离子半径比较:C>D>E>B
B. B、D、E简单气态氢化物稳定性比较:B>D>E
C. E最高价氧化物对应水化物的化学式为HEO4
D. C的单质在空气中燃烧产物的化学式为CO
难度: 困难查看答案及解析
-
某草酸二酯结构简式如图,下列说法正确的是

A. 草酸二酯的分子式为C26H22Cl6O8
B. 1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗4molNaOH
C. 草酸二酯能发生的反应类型有氧化、还原、取代、加成、聚合、酯化
D. 草酸二酯酸性条件下充分水解可以得到三种有机物
难度: 困难查看答案及解析
-
处理高浓度乙醛废水的新方法一隔膜电解法,让乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛一Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 若以CH4一空气燃料电池为直流电源,燃料电池的a极应通入甲烷
B. 电解过程中,阴极区Na2SO4的物质的量增大
C. 阳极反应为CH3CHO-2e-+H2O=CH3COOH+2H+
D. 阴极还原产物H2
难度: 困难查看答案及解析
-
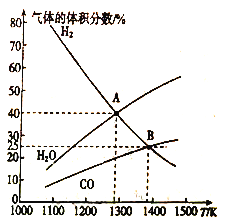
类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
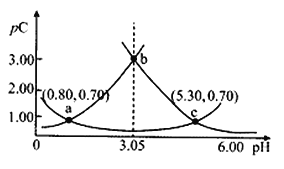
A. 随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B. pH=3. 50 时, c(HA-)>c(A2-)>c(H2A)
C. b点时c(H2A).c(A2-)/c2(HA-)=104.5
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
难度: 困难查看答案及解析

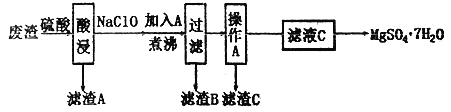
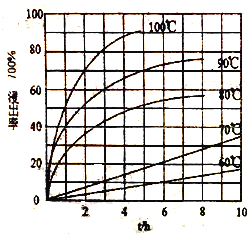
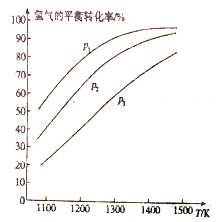
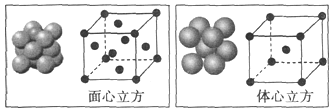
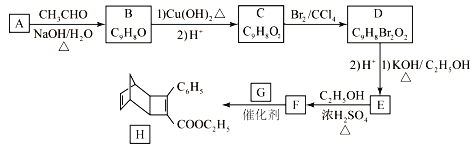
 CH3CH2OH ______________________________________________。
CH3CH2OH ______________________________________________。