-
化学与生产和生活密切相关。下列有关说法正确的是
A. 古代记载文字的器物——甲骨,其主要成分是蛋白质
B. 工艺装饰材料——天然水晶,属硅酸盐产品
C. 第五形态的碳单质——“碳纳米泡沫”,与石墨烯互为同分异构体
D. 秸秆经加工处理成吸水性的材料——植物纤维,可用作食品干燥剂
难度: 中等查看答案及解析
-
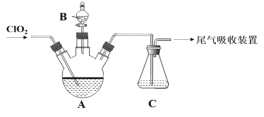
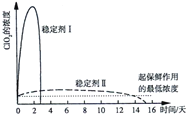
碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。

下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
难度: 困难查看答案及解析
-
叠氮酸钠(NaN3)是汽车安全气囊的产气剂,Fe2O3是主氧化剂,NaHCO3作冷却剂。当汽车发生剧烈碰撞时,分解产生大量气体使安全气囊迅速打开,从而起到安全保护作用[已知Ka(HN3)=1.8×10-5]。下列有关说法正确的是
A. NaHCO3的冷却原理是它发生分解,消耗体系的热量
B. Fe2O3和Na反应的氧化产物是Na2O2
C. 等物质的量的NaN3和HN3混合溶液显碱性
D. 若有6.5 gNaN3分解产生N2,则转移0.9 mol电子
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,部分元素在周期表中的位置如图所示,其中X、Y、W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物均能发生反应,下列说法中不正确的是
X
Y
W
A. 简单离子半径大小关系为:Y>Z>W
B. X与氢元素形成的化合物中,只含极性键
C. Z、W氧化物的熔点高低:Z<W
D. X与Y可以存在于同一离子化合物中
难度: 中等查看答案及解析
-
化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:
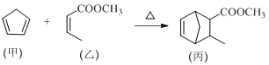
下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
难度: 中等查看答案及解析
-
过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
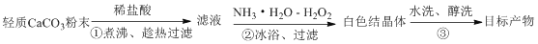
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
难度: 中等查看答案及解析
-
下列实验操作、现象及所得出的结论或解释均正确的是
选项
实验操作
现象
结论或解释
A
向盐酸中滴加Na2SO3溶液
产生使品红溶液褪色的气体
非金属性:Cl>S
B
向废FeCl3蚀刻液X中加入少量的铁粉,振荡
未出现红色固体
X中一定不含Cu2+
C
用c(Fe3+)相同的Fe2(SO4)3和FeCl3溶液,分别清洗做完银镜反应的试管
FeCl3溶液清洗得较干净
Fe3++Ag
Fe2++Ag+是可逆反应,且AgCl更难溶于水
D
用3 mL稀硫酸与纯锌粒反应,再加入几滴 Cu(NO3)2浓溶液
迅速产生无色气体
形成Zn-Cu原电池加快了制取H2的速率
A. A B. B C. C D. D
难度: 困难查看答案及解析