-
下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
难度: 中等查看答案及解析
-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
难度: 中等查看答案及解析
-
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A. Ba(OH)2 B. H2SO4 C. NaOH D. AgNO3
难度: 中等查看答案及解析
-
X 元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在无色玻璃试剂瓶中
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
难度: 中等查看答案及解析
-
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A. 2.4 g金属镁变为镁离子时失去的电子数为0.1NA
B. CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等
C. 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA
D. 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
难度: 中等查看答案及解析
-
将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中不正确的是( )
A. 该分散系能发生丁达尔现象 B. 该分散质颗粒能透过滤纸
C. 该分散质颗粒能透过半透膜 D. 该分散质颗粒能发生布朗运动
难度: 简单查看答案及解析
-
Se是人体必需微量元素,下列关于7834Se和8034Se的说法正确的是( )
A. 7834Se和8034Se互为同素异形体 B. 7834Se和8034Se都含有34个质子和中子
C. 7834Se和8034Se分别含有44和46个质子 D. 7834Se和8034Se互为同位素
难度: 中等查看答案及解析
-
Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合溶液中,能观察到的现象是: ①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
难度: 中等查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
C. 在金属元素区域可以寻找制备新型农药材料的元素
D. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
难度: 中等查看答案及解析
-
下列变化中需加入氧化剂才能实现的是( )
A. CuO→Cu B. Fe3+→Fe2+ C. Cl-→Cl2 D. H2SO4→BaSO4
难度: 简单查看答案及解析
-
在pH=1的无色溶液中,能够大量共存的离子组是( )
A. K+ 、Fe2+ 、Cl-、NO3- B. K+、CO32-、Na+ 、Cl-
C. Cu2+、Cl-、Ba2+ 、Na+ D. Mg2+ 、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式与化学反应事实一致的是( )
A. 石灰石溶于盐酸:CO32-+2H+ =H2O+CO2↑
B. 硫酸铜溶液与氢氧化钡溶液反应Cu2++2OH- =Cu(OH)2↓
C. 硫酸氢钠溶液与氢氧化钾溶液反应:H++OH-=H2O
D. 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
难度: 中等查看答案及解析
-
如果发现了原子序数为116的元素,下列对它的叙述中正确的是( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性
⑤属于氧族元素 ⑥属于锕系元素
A. ①③⑤ B. ②④⑥ C. ①③⑥ D. ③④⑤
难度: 简单查看答案及解析
-
用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是
A. +4 B. +3 C. +2 D. +1
难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是( )
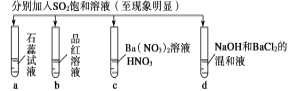
A
无色
无色
无现象
无色沉淀
B
红色
无色
白色沉淀
白色沉淀
C
红色
无色
无色溶液
白色沉淀
D
无色
无色
无色溶液
无色沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是( )
A. 原子半径:r(W)>r(Z)>r(Y)
B. 由X、Y组成的化合物只有一种
C. Y的最高价氧化物的水化物的碱性比Z的弱
D. X的简单气态氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径(×10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
主要化
合价
最高正价
+1
+7
+3
+2
+5
—
最低负价
—
-1
—
—
-3
-2
下列说法正确的是 ( )
A. 元素X和Q形成的化合物呈淡黄色
B. X、Z、R的最高价氧化物的水化物之间可两两相互反应
C. Q2-比R3-更容易失去电子
D. M(OH)2的碱性比XOH的碱性强
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠分别属于非电解质和电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析