-
化学与生产生活息息相关,下列有关叙述错误的是
A. 镀锡铁的抗腐蚀性比镀锌铁更强
B. 给手机充电时,电能转化为化学能
C. 泡沫灭火器的化学反应原理涉及水解反应
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
使用绿色能源有利于保护环境。下列能源中不属于绿色能源的是
A. 太阳能 B. 地热能 C. 风能 D. 煤
难度: 简单查看答案及解析
-
下列物质对水的电离不会产生影响的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
从能量变化看,有关
在
中燃烧说法错误的是
A. 该反应是放热反应
B. 形成
键放出能量
C. 燃烧时化学能转化成电能
D. 断裂
键吸收能量
难度: 简单查看答案及解析
-
下列各组物质反应后反应物和生成物的能量变化与图示相符的是
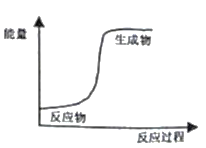
A. 铝热反应
B. 酸碱中和反应
C. 生石灰与水反应
D. Ba(OH)2·8H2O 与
反应
难度: 简单查看答案及解析
-
已知在10秒内N2(g)+3H2(g)
2NH3(g)反应体系中的
的浓度减少了
,则在这段时间内用
表示的反应速率是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
对已经达到化学平衡的反应:
,增大压强反应发生的变化是
A. 正逆反应速率都增大,平衡正向移动
B. 正逆反应速率都减小,平衡逆向移动
C. 正反应速率增大逆反应速率减小,平衡正向移动
D. 逆反应速率增大正反应速率减小,平衡逆向移动
难度: 简单查看答案及解析
-
下列解释事实的方程式错误的是
A. 小苏打溶液呈弱碱性:
B. 测得
的氨水的
C. 石墨比金刚石稳定:

D. 用碳酸钠处理水垢中的
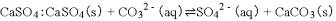
难度: 简单查看答案及解析
-
可逆反应Cl2(g)+H2O(l)
HCl(aq)+HClO(aq)达到平衡时,有关说法正确的是
A. 反应停止了
B. 体系中不存在
C. 黄绿色消失了
D. HClO浓度不再改变了
难度: 简单查看答案及解析
-
下列离子方程式中,不属于水解反应离子方程式的是
A.
B.
C.
D. CO32-+H2O
HCO3-+OH-
难度: 简单查看答案及解析
-
对于可逆反应:C(s)+CO2(g)
2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是
A. 将C(s)的表面积增大 B. 增大体系的压强
C. 升高体系的温度 D. 使用合适的催化剂
难度: 中等查看答案及解析
-
在一定条件下的溶液中,反应FeCl3+3KSCN
Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是
A. 加水稀释 B. 加入少量FeCl3固体
C. 加入少量KCl溶液 D. 加入少量氢氧化钠固体
难度: 中等查看答案及解析
-
在下面列出的事实中,不能证明乙酸
是弱酸的是
A.
的乙酸溶液的
约为3.0
B. 乙酸能跟
溶液反应放出二氧化碳
C. 相同浓度的乙酸和盐酸分别于与表面积完全相同的锌粒反应,盐酸反应速率快
D. 常温下,
乙酸钠溶液的
约为9
难度: 简单查看答案及解析
-
醋酸溶液中存在电离子平衡
,下列叙述错误的是
A. 醋酸溶液中离子浓度的关系满足:
B.
溶液中加少量的
固体,平衡逆向移动
C. 浓度均为
的
溶液和
溶液等体积混合后溶液的
D. 常温下,
的醋酸溶液与
的
溶液等体积混合后,溶液的
难度: 中等查看答案及解析
-
在常温下,将
的
溶液与
的
溶液等体积混合后,溶液的
最接近于(已知
)
A. 9.3 B. 9.7 C. 10.7 D. 10.3
难度: 中等查看答案及解析
-
已知A酸
的酸性比B酸
弱,在物质的量浓度均为
的
和
混合溶液中,下列排序的错误是
A.
B.
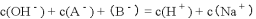
C.
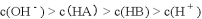
D.

难度: 中等查看答案及解析
-
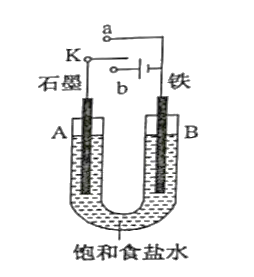
电化学气敏传感器可用于监测环境中
的含量,其工作原理如图所示,
被氧气化为
,下列说法错误的是
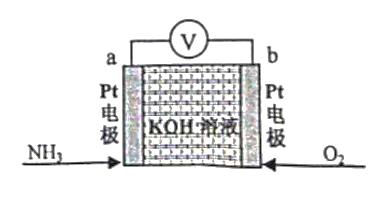
A. 溶液中
向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的
与
的物质的量之比为4:5
D. 正极的电极反应式为:
难度: 中等查看答案及解析
-
比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其对环境无污染,能量密度高,电池总反应为:
。下列说法中错误的是
A. 放电时负极反应为:
B. 若放电时转移
电子,则用去的锂为
g
C. 锂在放电时做负极材料,充电时为阴极材料
D. 该电池充电时阳极的反应为:
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应方程式为:
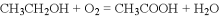 ,下列有关说法正确的是
,下列有关说法正确的是A. 外电路的电子由正极向负极移动
B. 若电路中有
电子转移,消耗2.24L的氧气
C. 电池正极的反应为
D. 电池负极的反应为
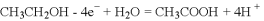
难度: 中等查看答案及解析
-
在一定温度下,当过量的
固体在水溶液中达到平衡时:
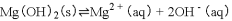 ,要使
,要使固体减少而
不变,可采取的措施是
A. 加适量的水 B. 加
溶液 C. 加
D. 加
难度: 中等查看答案及解析
 :
: