-
下列说法不合理的是
A. 古代常用明矾水除去铜器上的铜锈
B. 大量排放SO2、NO2会导致酸雨的形成
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 利用三氧化铬的氧化性检测驾驶员吹出的气体中是否含乙醇
难度: 中等查看答案及解析
-
科学家魏考克斯合成的一种有机物,分子结构如图。下列说法错误的是
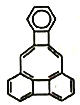
A. 该有机物的分子式为C22H12
B. 该有机物分子中含有4个苯环
C. 该有机物能发生加成反应
D. 该有机物的一氯取代物有6种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1mol甲基(-CH3)含有的质子数为9NA
B. 31gP4(
)中的共价键数目为1.5NA
C. 铜与浓硝酸反应生成1 moI NO2转移的电子数为NA
D. 22.4L(标准状况)氯气溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为2NA
难度: 中等查看答案及解析
-
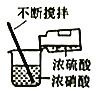
实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理,下列关于硝基苯的制备和纯化的装置不正确的是

A. 浓硫酸与浓硝酸混合
B. 制备硝基苯
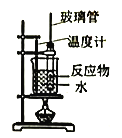
C. 用氢氧化钠溶液分离硝基苯中混有的酸
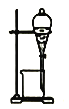
D. 分离硝基苯中混有的苯
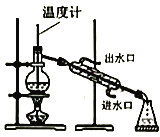
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,元素Y的原子核外电子数是W的2倍且在不同周期,X的最高价氧化物对应水化物的酸性是同周期中最强的,Z与W同主族。下列说法正确的是
A. 工业上常用电解熔融氧化物的方法制备Y单质
B. 简单离子半径的大小为Y>X
C. Z的简单氢化物的热稳定性比X的强
D. 化合物ZW、Z3X4均是耐高温材料
难度: 中等查看答案及解析
-
某研究所研制的锌碘液流电池,使用寿命长,可自我恢复。锌碘液流电池充电的工作原理如图所示,下列说法正确的是

A. 放电时,正极反应式是I3-+2e-=3I-
B. 充电时,b是电源的正极
C. 充电时,外电路通过2mol电子,则有2molK+通过多孔离子传导膜
D. 由电池的电极反应可推出还原性:I->Br- >Cl-
难度: 中等查看答案及解析
-
室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是
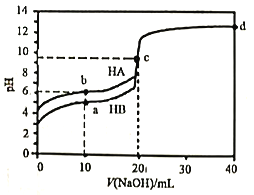
A. 水的电离度:c点溶液>纯水>b点溶液
B. 电离常数:Ka(HA)<Ka(HB)
C. d点溶液:2c(Na+)=c(A-)+(HA)
D. a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
难度: 中等查看答案及解析