-
化学与生活息息相关,下列有关说法正确的是
A. 二氧化硫和氨气都易液化,液氨常用作制冷剂
B. 硅酸是一种很弱的酸,可直接作为干燥剂
C. 漂白液、漂白粉、漂粉精的有效成分均是次氯酸钙
D. 豆浆一定是胶体
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 高纤维食物是富含膳食纤维的食物,在人体内都可以通过水解反应提供能量
B. “熔喷布”可用于制作N95型等口罩,生产“熔喷布”的主要原料是聚丙烯,它属于纯净物
C. 含有两个甲基,分子式为C6H13Cl的同分异构体有7种(不考虑立体异构)
D. 可以用碳酸钠溶液来区分乙酸、乙醇、苯
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 标准状况下22.4 L异丁烷的分子数为NA
B. 78 g苯(C6H6)和苯乙烯(C8H8)的混合物中含有的碳氢键数一定为6NA
C. 某温度下,1L pH=3的醋酸溶液稀释到10L时,溶液中H+的数目大于0.01NA
D. 向仅含0.2 mol FeI2的溶液中持续通入Cl2,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA 。(不考虑Cl2与H2O的反应)
难度: 中等查看答案及解析
-
著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
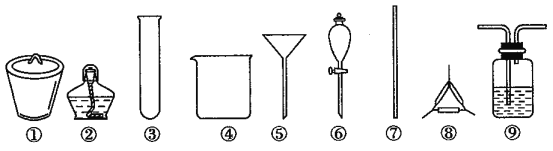
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
难度: 简单查看答案及解析
-
迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:
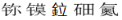 ,下列有关推断正确的是
,下列有关推断正确的是A. 这五种元素均为主族元素
B. 根据该名称,周期表118种元素中非金属元素共有24种
C. Nh的最高价氧化物是一种典型的两性氧化物
D. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
难度: 中等查看答案及解析
-
向V mL 0.1 mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH [pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是
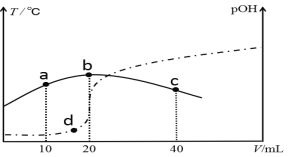
A. V =40
B. b点时溶液的pOH > pH
C. a、b、c三点由水电离的c(H+)依次减小
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
难度: 困难查看答案及解析
-
某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
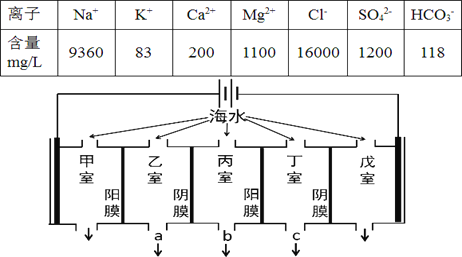
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
难度: 中等查看答案及解析
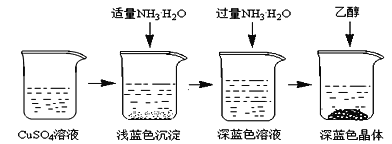

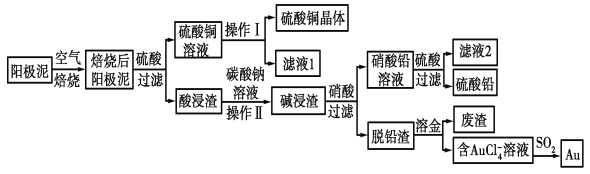

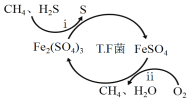
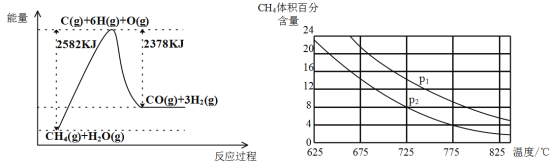
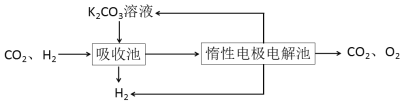
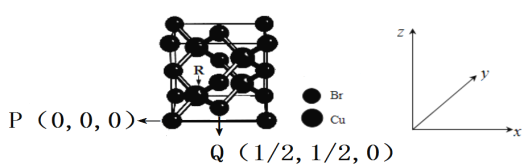
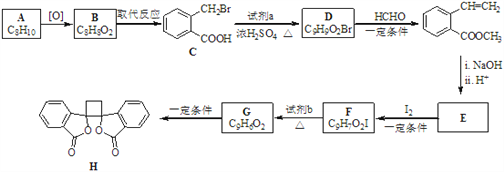
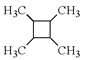 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________