-
2018年世界环境日中国主题是“美丽中国,我是行动者”。下列行为符合该主题的是
A. 尽量乘坐公共交通工具 B. 大量使用农药
C. 大力开采化石燃料 D. 推广使用一次性塑料餐具
难度: 简单查看答案及解析
-
对于2Na + 2H2O=2NaOH + H2↑,下列说法正确的是( )
A. Na+的结构示意图:
B. H2的摩尔质量:2 g·mol-1
C. H2O中O的化合价:-1 D. NaOH电离方程式:NaOH=Na++O2-+H+
难度: 简单查看答案及解析
-
22688Ra可用于辐照治疗癌症,下列关于22688Ra说法正确的是( )
A. 核电荷数为138 B. 核外电子数为226
C. 中子数为50 D. 与22888Ra互为同位素
难度: 简单查看答案及解析
-
用一束光照射某液体,产生一条光亮的通路。该液体是
A. NaCl溶液 B. Fe(OH)3胶体 C. 水 D. 稀硫酸
难度: 简单查看答案及解析
-
硅酸钠(Na2SiO3)溶液在建筑上可用作防腐剂与粘合剂,硅酸钠属于
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 简单查看答案及解析
-
下列属于化学变化的是
A. 碘升华 B. 冰块粉碎
C. 铜生锈 D. 浓盐酸挥发
难度: 简单查看答案及解析
-
下列有关工业生产的叙述中正确的是
A. 电解氯化钠溶液可得到金属钠
B. 光照氯气和氢气的混合物生产盐酸
C. 从铝土矿到铝单质过程中未涉及氧化还原反应
D. 工业接触法制硫酸的主要设备有沸腾炉、接触室、吸收塔
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A. Mg2+、K+、OH- B. Ba2+、Na+、SO42-
C. K+、HCO3-、OH- D. K+、Cu2+、NO3-
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. MgO具有高熔点,可用于制耐火材料
B. NaHCO3受热易分解,可用于治疗胃酸过多
C. 金属铜具有金属光泽,可用作导电材料
D. 浓硫酸具有脱水性,可用作干燥剂
难度: 中等查看答案及解析
-
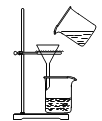
下列实验方法或操作正确的是
A. 蒸发NaCl溶液
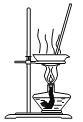 B. 测量HCl气体的体积
B. 测量HCl气体的体积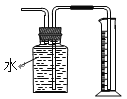
C. 过滤Ca(OH)2悬浊液
 D. 蒸馏乙醇
D. 蒸馏乙醇
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. NaHCO3溶液中滴加醋酸:CO32- + 2H+=H2O + CO2↑
B. 铁片上滴加FeCl3溶液:Fe + Fe3+=2Fe2+
C. AlCl3溶液中加入氨水:Al3+ + 3NH3•H2O=Al(OH)3↓+ 3NH4+
D. 氯气通入NaOH溶液中:Cl2 + OH-=Cl- + ClO- + H2O
难度: 中等查看答案及解析
-
以下六项中需在容量瓶上标出的是
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
A. ①②④ B. ②③⑤
C. ①⑤⑥ D. ①③⑤
难度: 简单查看答案及解析
-
含Na2SO4、MgSO4和NaNO3的1 L混合溶液,已知其中c(Mg2+)= 0.4 mol· L-1,c(SO42-)= 0.7 mol· L-1,c(NO3—)=0.2 mol·L-1,则此溶液中c(Na+)为
A. 0.2 mol·L-1 B. 0.4 mol·L-1
C. 0.6 mol· L-1 D. 0.8 mol· L-1
难度: 中等查看答案及解析
-
用无水Na2CO3配制250 mL 1.000 mol·L-1 Na2CO3溶液时,下列操作会使配制的溶液浓度偏大的是
A. 称量时碳酸钠固体含有结晶水
B. 移液时有液滴洒落瓶外
C. 定容时俯视容量瓶刻度线
D. 容量瓶没有干燥
难度: 困难查看答案及解析
-
分离提纯下列物质时选用的试剂或方法不正确的是
分离提纯
试剂
方法
A
除去Cl2中的HCl
NaOH溶液
洗气
B
提取溴水中的溴单质
CCl4
萃取
C
除去SiO2中的Fe2O3
稀盐酸
过滤
D
除去H2O中的 Fe3+
—
蒸馏
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
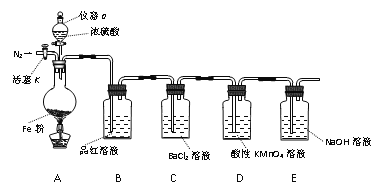
胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.
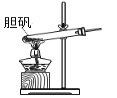 可用于胆矾分解 B.
可用于胆矾分解 B. 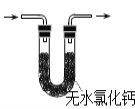 可用于检验产物是否含H2O
可用于检验产物是否含H2OC.
可用于收集SO2 D.
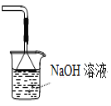 可用于吸收胆矾分解的SO2
可用于吸收胆矾分解的SO2难度: 中等查看答案及解析
-
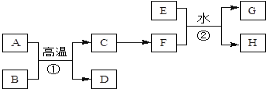
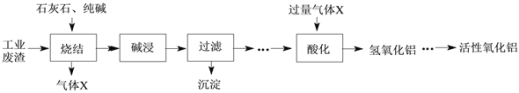
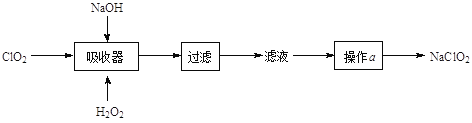
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
工业制备高铁酸钾的离子方程式为:2Fe(OH)3+3ClO-+4OH-
2FeO42-+3Cl-+5H2O。关于该反应的说法正确的是
A. FeO42-中铁显+3价 B. ClO-发生还原反应
C. Fe(OH)3是氧化剂 D. ClO-失去电子
难度: 简单查看答案及解析
-
下列有关离子检验的操作及结论均正确的是
A. 向无色溶液中先加适量盐酸酸化,再加AgNO3溶液,产生白色沉淀,则该溶液中一定含有Cl-
B. 向无色溶液中加入BaCl2溶液有白色沉淀出现,再加盐酸,沉淀不消失,则该溶液中一定含有SO42-
C. 向无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则该溶液中一定含有CO32-
D. 向某溶液中加入氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定含有NH4+
难度: 困难查看答案及解析
-
聚合硫酸铁[Fex(OH)y(SO4)z](铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL的溶液。②准确量取25.00 mL溶液,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体6.99g。③准确量取25.00mL溶液,加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥、灼烧至恒重,得到红棕色固体1.92g。该聚合硫酸铁组成中x∶y∶z的值为
A. 6∶8∶5 B. 4∶2∶5 C. 1∶1∶2 D. 6∶3∶5
难度: 中等查看答案及解析