-
下列体系中,离子可能大量共存的是
A. 滴加KSCN显红色的溶液:NH4+、K+、Cl-、HCO3-
B. 常温下,水电离出的c(H+)=1×10-12mol/L的溶液:Fe2+、Mg2+、SO42-、NO3-
C. 使酚酞试剂显红色的溶液:Na+、Ba2+、NO3-、A1O2-
D. 加入Al能产生H2的溶液:K+、NH4+、CH3COO-、Cl-
难度: 中等查看答案及解析
-
寿山石{X4[Y4Z10](ZW)8}的组成元素均为短周期元素,X的最高价氧化物对应水化物常用于治疗胃酸过多,X的简单离子与ZW- 含有相同的电子数,Y的单质是制造芯片的基础材料。下列说法正确的是( )
A. 简单氢化物的热稳定性:Y>Z B. 原子半径:Y>X >Z>W
C. 最高价氧化物水化物的酸性:X >Y D. NaW与水反应时作还原剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 常温下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,原子总数为NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 直径介于1 nm -100 nm之间的微粒可以制作纳米材料
B. 电泳现象可证明胶体带电
C. 石油的裂化和油脂的皂化均为化学变化,煤的干馏、石油的分馏以及蛋白质的盐析都是物理变化
D. 双氧水的电子式为
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 氯化铝溶液中加入过量的氨水:Al3+ +3OH- = Al(OH)3↓
B. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:NH4++Fe2++3OH-NH3·H2O+Fe(OH)2↓
C. 向碳酸氢钠溶液中滴加少量的氢氧化钡溶液:HCO3-+Ba2++OH-=BaCO3↓+ H2O
D. 向AgCl悬浊液中加入Na2S溶液,白色沉淀变成黑色:2AgCl+S2-Ag2S+2Cl-
难度: 中等查看答案及解析
-
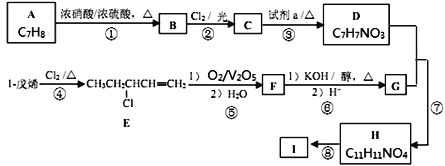
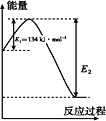
BHT是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法正确的是
A.
能与Na2CO3溶液反应生成CO2
B.
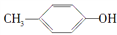 与BHT互为同系物
与BHT互为同系物C. BHT久置于空气中不会被氧化
D. 两种方法的反应类型都是加成反应
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. SO2具有氧化性,常用于漂白秸秆、织物
B. Na2O2与CO2可以发生反应,常用做供氧剂
C. 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D. 次氯酸有酸性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是
A. 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B. 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 简单查看答案及解析
-
已知常温时 HClO 的 Ka=3.0×10-8,HF 的 Ka= 3.5×10-4。现将 pH 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH 随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线 I 为次氯酸稀释时 pH 变化曲线
B. 取 a 点的两种酸溶液,中和相同体积、相同浓度的NaOH 溶液,消耗次氯酸的体积较小
C. a 点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b 点溶液中水的电离程度比 c 点溶液中水的电离程度小
难度: 困难查看答案及解析
-
A、B、C是常见的三种单质,A、B、C及其他物质之间的反应关系如图所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F,且常温下只有B为气态,则A、B、C分别为
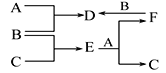
A. Fe、Cl2、Cu
B. Fe、Cl2、H2
C. Cu、Cl2、Fe
D. Fe、Cl2、Mg
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论错误的是
选项
操作
现象
结论
A
相同的铝片分别与同温同体积,且c(H+)=1mo l·L-1的盐酸、硫酸反应
铝与盐酸反应产生气泡较快
可能是Cl-对该反应起到促进作用
B
常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞试液
Na2CO3溶液中红色更深
水解平衡常数Kh:CO32->HCO3-
C
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成
Fe2+催化H2O2分解产生O2;H2O2分解反应放热,促进Fe2+的水解平衡正向移动
D
向浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
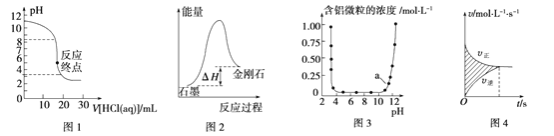
A. 图1表示0.001 mol·L-1盐酸滴定0.001 mol·L-1 NaOH溶液的滴定曲线
B. 图2表示从能量角度考虑,石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中含大量Al3+
D. 图4所示图中的阴影部分面积的含义是(v正-v逆)
难度: 中等查看答案及解析
-
混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示,其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
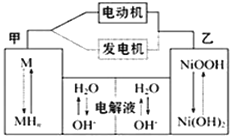
A. 发电机充电时,阴极附近pH降低
B. 电动机工作时溶液中OH﹣向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH
M+Ni(OH)2
难度: 中等查看答案及解析
-
下列叙述与对应图像或数据描述正确的是
①
②
③
④
⑤
⑥
⑦
⑧
原子半径
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最低化合价
-2
+2
+1
-3、+5
-1、+7
+1
-3、+5
+3
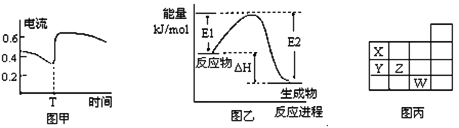
A. 由上述短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱性最强
B. 图甲表示Zn—Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
C. 图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
D. 图丙表示周期表的一部分,元素X、Y、Z、W中X的氢化物酸性最强
难度: 中等查看答案及解析
-
CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是

A. 该反应的ΔH<0
B. 在500℃条件下达平衡时CO 的转化率为60%
C. 平衡常数K1(3000C)<K2(5000C)
D. 图2中达化学平衡的点为c、d、e
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A. 向0.1 mol·L−1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(
)+c(
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(
)−c(H2SO3)=9.9×10−7 mol·L−1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:
<
D. 0.1 mol·L−1 Na2C2O4溶液与0.1 mol·L−1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(
)+c(
)+c(OH−)=c(Na+)+c(H+)
难度: 中等查看答案及解析
-
某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是
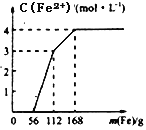
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
D. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
难度: 中等查看答案及解析
-
化学与材料、生活密切相关,下列说法错误的是
A. “一带一路”是“丝绸之路经济带”的简称,丝绸的主要成分是纤维素
B. 喝补铁剂(含Fe2+)时,加服维生素C效果更好,因维生素C具有还原性
C. 推广使用CO2合成的可降解聚碳酸酯塑料,能减少白色污染
D. “神舟十一号”宇宙飞船返回舱外表面使用高温结构陶瓷是新型无机非金属材料
难度: 简单查看答案及解析