-
短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是
A. 离子半径: W<Y<Z
B. 工业上采用电解Y 的氧化物冶炼单质Y
C. W、X元素组成的化合物一定只含离子键
D. W、X、Z三种元素组成的化合物的水溶液可能显碱性
难度: 中等查看答案及解析
-
化学与人类生产、生活密切相关,下列叙述中不正确的是
A. 从花生中提取的生物柴油和从石油炼得的柴油都属于烃类物质
B. “光化学烟雾”、“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关
C. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料
D. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2C=CHCH3分子中所有原子在同一平面上
B. 分子式为C3H6Br2的有机物共有4个同分异构体(不含立体异构)
C. 乙二醇和甘油互为同系物
D. 结构式为…-CH =CH—CH =CH—CH =CH—CH=CH-…的高分子化合物,其单体是乙烯
难度: 中等查看答案及解析
-
下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是
选项
操作和现象
结论
A.
常温下,测得饱和Na2S溶液的pH大于饱和Na2CO3溶液
常温下水解程度:S2->CO32-
B.
向电石中加入饱和食盐水制乙炔,并将产生的气体直接通入酸性高锰酸钾溶液中,溶液紫红色褪去
证明乙炔能被酸性高锰酸钾氧化
C.
向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅
Na2CO3溶液中存在水解平衡
D.
向分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液至紫色
CC14可作为碘的萃取剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
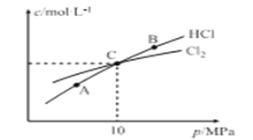
2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水
NaClO3
NaClO4
NaClO4
 NH4ClO4
NH4ClO4下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
难度: 中等查看答案及解析
-
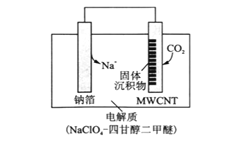
一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是
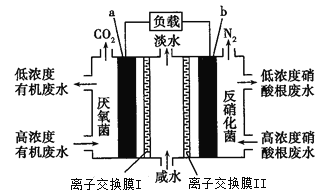
A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
难度: 困难查看答案及解析
-
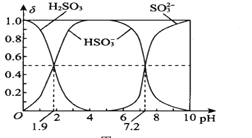
某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10−25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2−)+c(HS−)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10−36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10−5 mol•L−1的混合溶液中逐滴加入10−4 mol•L−1的Na2S溶液,Zn2+先沉淀
难度: 困难查看答案及解析
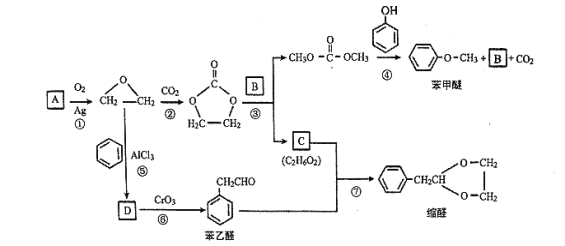
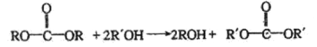
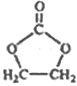 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备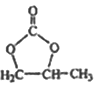 的合成流程图:_______。
的合成流程图:_______。