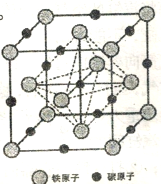
-
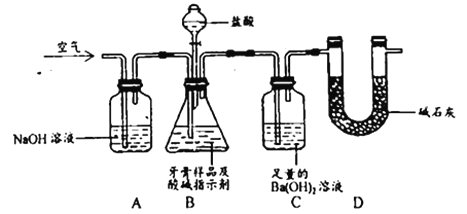
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的是
实验目的
实验方案
玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的浓溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明CH3COOH的酸性强弱
用pH试纸测定0.1mol/LCH3COONa溶液的pH
玻璃棒
玻璃片
C
证明AgBr的溶度积比AgCl小
向AgNO3溶液中先滴加NaCl溶液,出现白色沉淀后,再向其中滴加同浓度的NaBr溶液
试管、滴管
D
配制1L16%的CuSO4溶液(溶液密度≈1g/mL)
将25gCuSO4·5H2O溶解在975g水中
烧杯、量筒、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活、生产密切相关,下列说法不正确的是
A. 用灼烧的方法可以区分人造丝(纤维素)和蚕丝织物
B. 二氧化氯(ClO2)是新型水处理剂,具有消毒杀菌作用
C. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D. “光化学烟雾”、“硝酸酸雨”的形成都与氮氧化物有关
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 一定条件下,乙酸能够与CuO反应,而乙醇不能
B. 甲烷、甲苯、乙醇、乙酸和酯类都可以发生取代反应
C. 基本营养物质都是能发生水解反应的高分子化合物
D. 乙烯、乙醇、苯都能与酸性KMnO4溶液发生反应
难度: 中等查看答案及解析
-
任意两个环共用两不直接相连的碳原子的环烃称为桥环化合物。金刚烷就是其中的一种,其结构如图示。下列关于该化合物的说法错误的是
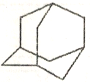
A. 与癸烷互为同分异构体 B. 二氯代物超过3种
C. 分子结构中不含甲基 D. 结构中含有2个以上6元环
难度: 中等查看答案及解析
-
W、X、Y、Z是短周期元素,原子序数依次递增。W与Y位于同一主族,X的单质既能与盐酸反应也能与NaOH溶液反应,Y原子的最外层电子数是次外层电子数的一半,X、Y、Z原子的最外层电子数之和为14。下列说法不正确的是
A. 原子半径X>Y
B. X与Z形成的化合物的水溶液pH<7
C. 最简单气态氢化物的稳定性W<Y<Z
D. Y与Z形成的化合物分子属于非极性分子
难度: 中等查看答案及解析
-
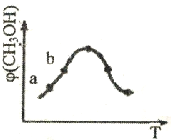
25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是
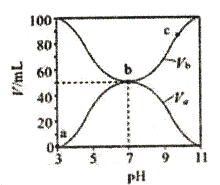
A. Ka(HA)=Kb(BOH)=1×10-6 B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+) D. a→c过程中
不变
难度: 中等查看答案及解析
-
据报导,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚,电池总反应为:4Na+3CO2
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时吸收CO2,充电时释放CO2
C. 放电时Na+向碳纳米管移动
D. 放电时的负极反应为2Na-2e-+CO32-=Na2CO3
难度: 中等查看答案及解析

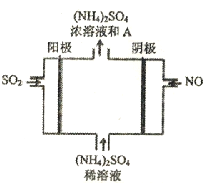
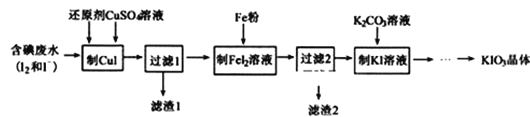
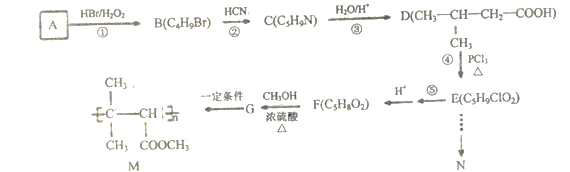
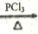
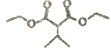 )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。