-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 碱性锌锰电池是二次电池
B. 铅蓄电池是二次电池
C. 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D. 燃料电池的活性物质没有储存在电池内部
难度: 简单查看答案及解析
-
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是
A.
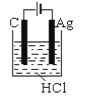 B.
B. 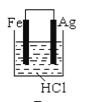 C.
C. 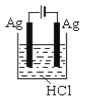 D.
D. 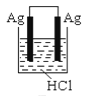
难度: 简单查看答案及解析
-
在铁制品上镀上一定厚度的锌层,以下方案设计正确的是( )。
A. 锌作阳极,镀件作阴极,溶液中含有锌离子
B. 铂作阴极,镀件作阳极,溶液中含有锌离子
C. 铁作阳极,镀件作阴极,溶液中含有亚铁离子
D. 锌作阴极,镀件作阳极,溶液中含有锌离子
难度: 中等查看答案及解析
-
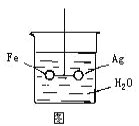
如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是( )
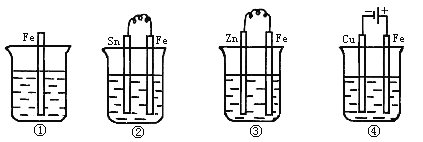
A. ④>②>①>③ B. ②>①>③>④
C. ④>②>③>① D. ③>②>④>①
难度: 简单查看答案及解析
-
现有0.01mol/L的下列溶液:①CH3COOH②NaHCO3③NaHSO4④KOH⑤H2SO4按pH由小到大的顺序排列的是( )
A. ⑤③①②④ B. ③⑤①②④ C. ⑤②③①④ D. ④②①③⑤
难度: 中等查看答案及解析
-
在298K、100kPa时,已知:2H2O(g)═2H2(g)+O2(g) △H1
H2(g)+Cl2(g)═2HCl(g) △H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A. △H3=△H1+2△H2 B. △H3=△H1+△H2
C. △H3 =△H1-2△H2 D. △H3=△H1-△H2
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸⑥硫酸钠溶液
A. ①③⑤ B. ②④⑤ C. ②④ D. ②④⑥
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 在AgCl悬浊液中加入KI溶液充分震荡:Ag+ +I-=AgI↓
B. 氢氧燃料电池的负极反应:O2 +2H2O +4e- =4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu2+ +2e-=Cu
D. 钢铁发生电化腐蚀的负极反应式:Fe-2e-=Fe2+
难度: 简单查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构如图所示。关于该电池的叙述正确的( )
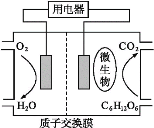
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O-24e-6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体5.6L
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
难度: 中等查看答案及解析
-
室温下,水的电离达到平衡:H2O
H+ +OH-。下列叙述正确的是( )
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时每转移3mol电子,正极有1molK2FeO4被氧化
B. 充电时阳极反应为:Fe(OH)3+5OH-3e-=FeO42-+4H2O
C. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
D. 放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)
3C(g)+D(g),若反应开始时充入2 mol A和1 mol B,达到平衡时C的浓度为 a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+3 mol C+1 mol D
C. 3 mol C+1 mol D+1 mol B D. 3 mol C+1 mol D
难度: 困难查看答案及解析
-
对“AgCl(s)
Ag+(aq)+Cl-(aq)”的理解正确的是( )
A. 说明AgCl没有完全电离,AgCl是弱电解质
B. 说明溶解的AgCl已完全电离,是强电解质
C. 说明Cl-与Ag+的反应不能完全进行到底
D. 说明Cl-与Ag+可以完全进行到底
难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡CH3COOH
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
难度: 中等查看答案及解析
-
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,为使
被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分的判断正确的是( )
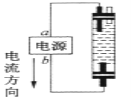
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O═Cu2O+H2↑。下列说法正确的是( )
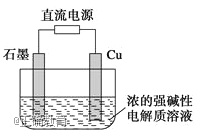
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1mol电子转移时,有0.1molCu2O生成
难度: 简单查看答案及解析