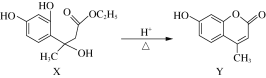
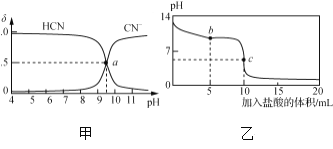
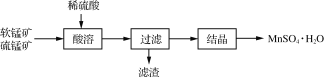
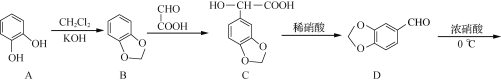
-
“建设天蓝、地绿、水清的美丽中国”是每个中国人的愿望。下列做法与此相符的是( )
A. 将农作物秸秆就地焚烧,增强土壤肥效
B. 将电器垃圾深埋处理,减少重金属对环境的危害
C. 将三聚磷酸钠(Na5P3O10)添加到洗衣粉中,增强去污效果
D. 将煤炭气化、液化和干馏等处理,获得清洁能源和重要的化工原料
难度: 简单查看答案及解析
-
用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. SiO2是酸性氧化物,可用作光导纤维
B. NaHCO3受热易分解,可用于制胃酸中和剂
C. Na2S具有还原性,可用于去除水体中的Hg2+
D. FeCl3具有氧化性,可用作铜制线路板的蚀刻剂
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=12的溶液:Na+、K+、NO3-、ClO-
B. 能使甲基橙变红的溶液:Na+、NH4+、Cl-、CH3COO-
C. 1.0 mol·L-1的KNO3溶液:Fe2+、H+、SO42-、I-
D. 0.1 mol·L-1 NaAlO2溶液:NH4+、Al3+、Cl-、CO32-
难度: 中等查看答案及解析
-
下列表述不正确的是( )
A. 常温下,浓硝酸、浓硫酸可贮存在铝制容器中
B. 处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再用酸除去
C. 向滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色褪去,则BaCl2溶液呈酸性
D. 向苯酚浊液中滴入Na2CO3溶液,溶液变澄清,则苯酚电离出H+的能力大于HCO3-
难度: 中等查看答案及解析
-
下列制取SO2、验证其性质的装置(尾气处理装置已省略)和原理不能达到实验目的的是( )
A.
 制取SO2 B.
制取SO2 B. 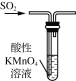 验证漂白性
验证漂白性C.
 验证还原性 D.
验证还原性 D. 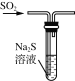 验证氧化性
验证氧化性难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 漂白粉露置在空气中失效:2ClO-+CO2+H2O===2HClO+CO32-
B. 银氨溶液中滴加过量的盐酸:Ag(NH3)2++2H+===Ag++2NH4+
C. 二氧化锰与浓盐酸共热制取氯气:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
D. 用碱性NaClO溶液吸收冶金工业尾气中的NO2:ClO-+2NO2+H2O===Cl-+2NO3-+2H+
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y为金属元素,且Y的原子序数小于X和Z的最外层电子数之和,Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是( )
A. 原子半径:r(W)>r(Y)>r(X)
B. X与Y组成的化合物中均不含共价键
C. Z的简单气态氢化物的热稳定性比W的强
D. WX2是一种高效安全灭菌消毒剂
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是( )
A. N2(g)
NO(g)
NaNO2(aq)
B. SiO2
Na2SiO3
H2SiO3
C. Al
NaAlO2
Al(OH)3
D. Fe3O4(s)
Fe(s)
Fe(NO3)3(aq)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体
Na2O2没有变质
B
取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀
CH3CH2Br没有水解
C
室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5
HSO
结合H+的能力比SO
强
D
向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色
Fe3+与I-的反应为可逆反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.
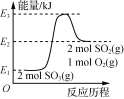 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1B.
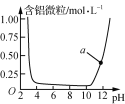 表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+C.
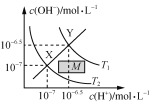 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)D.
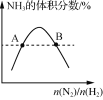 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)难度: 困难查看答案及解析