-
化学与生活密切相关,下列有关说法正确的是
A. 煤经过气化、液化等一系列物理变化可转变为清洁燃料
B. 用植物秸秆造纸并将废水通过高压水井压到地下,可节约能源
C. 食品袋内活性炭粉、活性铁粉和
组成的混合物作除氧剂和干燥剂
D. 华为手机
外壳上贴的碳纤维膜是一种新型有机高分子材料
难度: 简单查看答案及解析
-
下列实验操作、现象及所得出的结论或解释均正确的是
选项
实验操作
现象
结论或解释
①
用玻璃棒蘸取次氯酸钠溶液,点在
试纸上
试纸最终显蓝色
次氯酸钠溶液显碱性
②
向废
蚀刻液X中加入少量的 铁粉,振荡
未出现红色固体
X中一定不含
③
将
溶液滴入
溶液中至不在有沉淀产生,再滴加
溶液
白色沉淀变为蓝色沉淀未出现红色固体
的比
的小
④
用
稀硫酸与纯锌粒反应,再加入几滴
浓溶液
迅速产生无色气体
形成锌铜原电池加快制取氢气的速率
A. ① B. ② C. ③ D. ④
难度: 中等查看答案及解析
-
用
与
反应可制取纳米铁
 下列说法正确的是
下列说法正确的是A. 该反应中氧化剂只有
B.
的电子式为

C.
与稀硫酸不发生反应 D. 该反应中每生成
,转移的电子数为
难度: 中等查看答案及解析
-
下列说法正确的是
A. 向
溶液中逐滴加入
溶液至刚好沉淀完全,反应的离子方程式为

B. 25℃时,加水稀释
,溶液中
不断增大
C. 用浓盐酸分别和
、
反应制备
氯气,转移的电子数均为
(
为阿伏加德罗常数的值)
D. 相同物质的量浓度的下列溶液中,①
、②
、③
、④
其
由大到小的顺序是:①>②>③>④
难度: 中等查看答案及解析
-
是原子序数依次增大的短周期元素,且
原子序数之和是
原子序数之和的
。甲、乙、丙、丁是由这些元素组成的二元化合物,
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
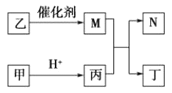
A. 由四种元素形成的两种盐,水溶液中反应能生成
B.
与
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物
、乙烯使溴水褪色的原理相同
D.
与
形成的化合物中,成键原子均满足8电子结构
难度: 中等查看答案及解析
-
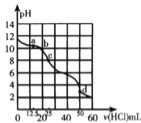
室温下,将尿酸钠(
)悬浊液静置,取上层清液,再通入
,溶液中尿酸的浓度
与
的关系如图所示。己知:
,
,下列说法正确的是

A. 上层清液中,
B. 当
时,
C. 在
的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
D. 当
时,
难度: 中等查看答案及解析
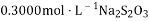 溶液滴定至终点,消耗
溶液滴定至终点,消耗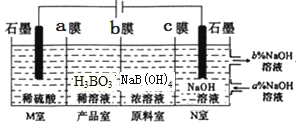


 ,是一种重要的化工中间体。以环己醇(
,是一种重要的化工中间体。以环己醇( 的合成路线。
的合成路线。
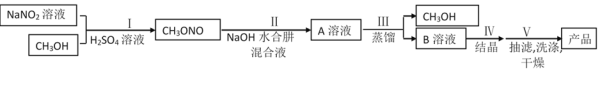
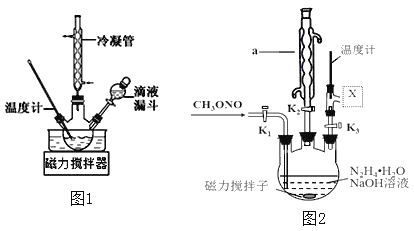
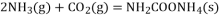
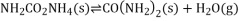
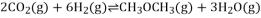
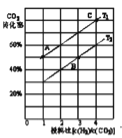
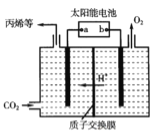
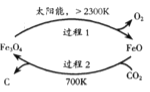
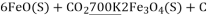 ;则过程1中每消耗
;则过程1中每消耗