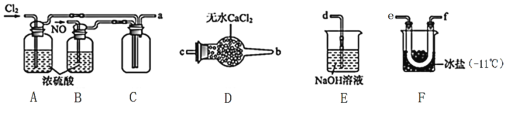
-
物质的结构、性质和用途之间有着非常密切的关系。下列有关物质的性质和用途均正确且有因果对应关系的是
选项
性质
用途
A
ClO2具有还原性
ClO2可用于自来水的杀菌消毒
B
常温下,氨气能与氯气反应
浓氨水检验氯气管道泄漏
C
碳单质的还原性强于硅单质
碳单质与石英反应冶炼粗硅
D
铁能被浓硫酸钝化
铁制器皿用作铜和浓硫酸的反应容器
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 因发生加成反应,苯可以使溴水褪色
B. 煤可以通过干馏、液化与气化等物理变化转化为清洁能源
C. 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
D. 分子式为C10H14且只有一个取代基的芳香烃,其可能的结构有4种
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA
B. 1 L 0.1 mol·L−1的NaHCO3溶液中
和
离子数之和为0.1NA
C. 在一定温度下64gSO2与足量氧气充分反应,转移电子数为4NA
D. 含有NA个Fe( OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56g
难度: 中等查看答案及解析
-
由下列实验及现象推出的相应结论正确的是
实验
现象
结论
A
向某溶液中加入NaOH稀溶液,管口放置湿润的红色石蕊试纸
试纸不变色
原溶液中一定没有NH4+
B
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
该溶液中有Fe2+
C
向盛有2 mL FeCl3溶液的试管中滴加几滴浓的维生素C溶液
黄色褪为无色
维生素C具有氧化性
D
向4mL0.1mol/LNa2S溶液中滴入几滴0.1mol/L ZnCl2溶液,再加入CuSO4溶液
先产生白色沉淀,后产生黑色沉淀
Ksp (CuS)<Ksp (ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列为四个常用的电化学装置,关于它们的叙述正确的是
A.
 正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-B.
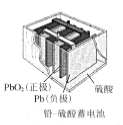 放电时,外电路中通过2mol电子,理论上正极质量增加96g
放电时,外电路中通过2mol电子,理论上正极质量增加96gC.
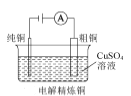 阳极质量的减小值等于阴极质量的增加值
阳极质量的减小值等于阴极质量的增加值D.
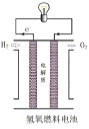 电池的总反应及电极反应均与电解质溶液的酸碱性无关
电池的总反应及电极反应均与电解质溶液的酸碱性无关难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的某一种盐加入稀盐酸后,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
A. W、X、Y、Z的简单离子的半径依次增大
B. 简单氢化物的热稳定性:X<W
C. ZX2在氧气中可以燃烧产生白雾
D. W所形成的一种氢化物可用作火箭燃料
难度: 中等查看答案及解析
-
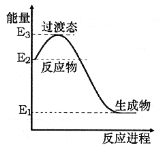
工业生产中,向Na2CO3溶液中通入SO2气体制备无水Na2SO3,水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布、Na2SO3的溶解度曲线如图所示:
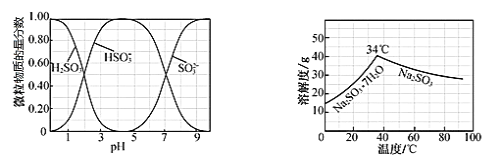
下列说法不正确的是:
A. 溶液pH=4时,溶质为NaHSO3
B. 溶液pH=10时,c(Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–)
C. 溶液pH=7时, c(SO32–)= c(HSO3–)
D. 溶液pH=10时,停止通入SO2,将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3
难度: 困难查看答案及解析