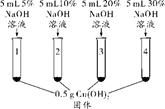
-
下列物质的用途中,说法错误的是( )
A. 碳酸氢铵用作化肥
B. 碳酸钙可作补钙剂
C. 硫酸用于车用电池
D. 盐酸可用于食品工业
难度: 中等查看答案及解析
-
下列物质的名称、俗名或主要成分与化学式对应不正确的是( )
A. 氯化钠 食盐 NaCl
B. 碳酸氢钠 纯碱 NaHCO3
C. 氧化钙 生石灰 CaO
D. 氢氧化钠 火碱 NaOH
难度: 中等查看答案及解析
-
X是一种氧化物,能发生反应:①X+酸→盐+水;②X+水→碱,则氧化物X是( )
A. 氧化钙 B. 二氧化硫 C. 一氧化碳 D. 氧化铁
难度: 中等查看答案及解析
-
下列物质的用途,主要利用了物质化学性质的是
A.水作溶剂 B.熟石灰用于改良酸性土壤
C.氦气用于填充气球 D.铜用于制导线
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 碳酸盐与酸反应生成气体,与酸反应生成气体的物质一定是碳酸盐
B. CO2能使燃着的木条熄灭,所以能使燃着的木条熄灭的一定是CO2
C. 中和瓜生成了盐和水,所以生成盐和水的反应的一定是中和反应
D. 酸性溶液使紫色石蕊溶液变红色,所以使紫色石蕊溶液变红色的溶液一定是酸性溶液
难度: 中等查看答案及解析
-
下列除去杂质的方法中,正确的是( )
选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
加过量碳酸钙,过滤
B
K2CO3溶液
KCl
加适量稀盐酸
C
CaO
CaCO3
加水,过滤
D
NaCl溶液
Na2CO3
加适量石灰水溶液,过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是( )
锥形瓶
胶头滴管
A
MnO2
H2O2
B
Zn
稀H2SO4
C
H2O
浓H2SO4
D
HCl气体
石灰水

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向一定量的碳酸氢钠和氯化钠的混合溶液中加入稀盐酸溶液至过量,某变量 y随x的变化趋势如下图所示。若x表示稀盐酸的质量,则y表示的含义是
A. 氯化钠的质量 B. 溶液的总质量
C. 二氧化碳的质量 D. 溶液中钠元素的质量
难度: 困难查看答案及解析
-
下列四个图像中,能正确反映对应实验操作的是( )
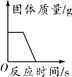
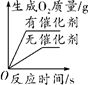


A.加热一定量的高锰酸钾
B.用等质量、等质量分数的双氧水制取氧气
C.向一定量的稀盐酸中加入氢氧化钠溶液
D.某温度,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
同学们用下图所示装置进行实验,验证CO2与NaOH、Ca(OH)2都能发生反应。
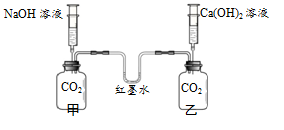
分别向甲、乙两个瓶中注入少量、等体积的两种溶液,观察实验现象。
(1)甲中反应的化学方程式是 。说明CO2能与Ca(OH)2反应的实验现象是 。
(2)下列实验现象中,一定能说明“CO2与NaOH发生了化学反应”的是 (填序号)。
a.U型管中红墨水左低右高
b.U型管中红墨水左高右低
c.U型管中红墨水液面没有发生改变
难度: 简单查看答案及解析