-
主链上含5个碳原子,有甲基、乙基2个支链的烷烃有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 困难查看答案及解析
-
ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,关于20Ne和22Ne的说法正确的是
A. 20Ne和22Ne互为同位素 B. 20Ne和22Ne互为同分异构体
C. 20Ne和22Ne的质量数相同 D. 20Ne和22Ne的中子数相同
难度: 中等查看答案及解析
-
金属的冶炼一般用热分解法、热还原法和电解法,选用冶炼方法的依据主要是
A. 金属在自然界里存在的形式 B. 金属元素在地壳中的含量
C. 金属阳离子得电子的能力 D. 金属熔点的高低
难度: 简单查看答案及解析
-
三氯化氮(NCl3)的分子结构类似于NH3,具有三角锥型结构。下列有关说法错误的是
A. N—Cl键是极性键 B. NCl3分子为极性分子
C. 氨气是电解质 D. Al(OH)3难溶于氨水
难度: 简单查看答案及解析
-
石油裂化的主要目的是
A. 提高轻质液体燃料的产量
B. 便于分馏
C. 提高汽油的质量
D. 获得断链不饱和气态烃
难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )
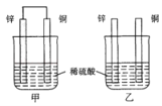
A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
难度: 中等查看答案及解析
-
下列叙述中描述的物质一定是金属元素的是
A. 易失去电子的物质
B. 第三周期中,原子的最外电子层只有2个电子的元素
C. 单质具有金属光泽的元素
D. 原子的最外电子层只有1个电子的元素
难度: 简单查看答案及解析
-
下列各组溶液用互滴法不能鉴别的是
A. 硝酸银溶液和氨水 B. 盐酸和碳酸钠溶液
C. 明矾溶液与烧碱溶液 D. 碳酸氢钠和澄清石灰水
难度: 中等查看答案及解析
-
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
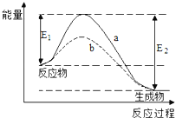
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
难度: 简单查看答案及解析
-
根据相关的化学原理,下列推断错误的是
A. 若X是原子晶体,Y是分子晶体,则熔点:X>Y
B. 若A2+2D-→2A-+D2,则氧化性:A2>D2
C. 若R2-和M+的电子层结构相同,则离子半径:R2-<M+
D. 若弱酸HA、HB的酸性HA>HB,则同浓度钠盐溶液的碱性:NaA<NaB
难度: 中等查看答案及解析
-
下列实验操作错误的是
A. 蒸发时,应将溶液放入坩埚中加热到出现大量晶体,还余少量溶液停止加热
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
对于0.1mol∙L-1Na2SO3溶液,下列表述正确的是
A. 升高温度,溶液的pH降低
B. 加入少量NaOH固体,c(SO32-)与c(Na+)均增大
C. c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D. c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
难度: 简单查看答案及解析
-
在室温下,将pH=3的酸和pH=11的碱等体积混合,混合后溶液的pH>7,则该酸和碱的组合可以是
A. 醋酸和氢氧化钡 B. 硝酸和氢氧化钠
C. 硫酸和氢氧化钾 D. 盐酸和氨水
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,
B. 若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是:
难度: 中等查看答案及解析
-
往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,下列说法正确的是
A. 该实验表明FeCl3有还原性 B. 白色沉淀为BaSO3
C. 该实验表明SO2有漂白性 D. 反应后溶液酸性增强
难度: 中等查看答案及解析
-
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项
W
X
Y
Z
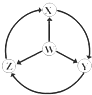
A
S
SO2
SO3
H2SO4
B
Na
Na2O2
NaOH
NaCl
C
Fe
FeCl3
Fe(OH)2
FeCl2
D
Al
AlCl3
NaAlO2
Al2(SO4)3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到正高碘酸二氢三钠(Na3H2IO6)。下列有关该反应的说法错误的是
A. 该反应中碘酸钠作还原剂
B. 碱性条件下,氯气的氧化性强于正高磷酸二氢三钠的氧化性
C. 反应物中氧化产物与还原产物的物质的量之比为2:1
D. 反应中生成1mol Na3H2IO6转移2NA个电子
难度: 中等查看答案及解析
-
下列有关物质检验的实验结论正确的是
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有
B
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定为
D
将少量有机物滴加到新制氢氧化铜溶液中,充分振荡,未见红色沉淀生成
该有机物不含醛基
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g)+Q(Q>0)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,分析正确的是

A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化速率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
难度: 中等查看答案及解析
-
在含有Na+的中性溶液中,还可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种,进行如下实验:(1)原溶液加足量氯水后,有气泡生成,溶液呈橙黄色;(2)向橙黄色溶液中加BaCl2溶液无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝。由此推断溶液中一定不存在的离子是
A. NH4+、Br-、CO32- B. NH4+、I-、SO32-
C. Fe2+、I-、SO32- D. Fe2+、I-、CO32-
难度: 中等查看答案及解析
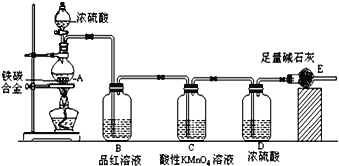
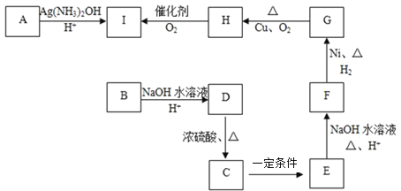
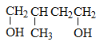 的合成路线_____,(合成路线常用的表示方式为:甲
的合成路线_____,(合成路线常用的表示方式为:甲