-
满足分子式为C5H11Cl的有机物共有
A. 6种 B. 7种 C. 8种 D. 9种
难度: 中等查看答案及解析
-
把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A. 10∶1 B. 1∶10
C. 1∶100 D. 1∶2
难度: 中等查看答案及解析
-
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A. NH4CI B. NH4HCO3 C. NH4HS04 D. (NH4)2SO4
难度: 简单查看答案及解析
-
对于可逆反应A (g)+2B(g)
2C (g) ΔH<0,达到平衡时,要使正反应速率增大,且使A的转化率增大,以下采取的措施可行的是
A. 升高温度 B. 增大A的浓度 C. 减少C的浓度 D. 增大压强
难度: 中等查看答案及解析
-
下列不能用勒夏特列原理解释的事实是( )
A. 棕红色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
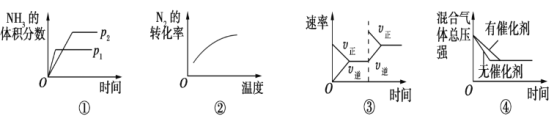
A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)
4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
t/s
0
500
1000
1500
c(N2O5)mol/L
5.00
3.52
2.50
2.50
下列说法不正确的是
A. 500s内N2O5分解速率为2.96×10—3mol/(L· s)
B. T1温度下的平衡常数为K1=125(mol/L)3,1000s时转化率为50%
C. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1> K3
D. 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
难度: 中等查看答案及解析
-
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
A. CaCO3的溶解度小于CaSO4
B. 沉淀转化的实质是沉淀溶解平衡的移动
C. 沉淀转化的难易与溶解度差别的大小无关
D. CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
难度: 中等查看答案及解析
-
乙醇分子结构式如图所示,下列反应及断键部位不正确的是( )
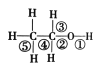
A. 乙醇与钠的反应是① 键断裂 B. 乙醇的催化氧化反应是②③键断裂
C. 乙醇燃烧反应是全部键断裂 D. 乙醇与乙酸发生酯化反应是①键断裂
难度: 中等查看答案及解析
-
将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( )
A. 生成的乙酸乙酯中含有18O
B. 生成的水分子中不含有18O
C. 可能生成88 g乙酸乙酯
D. 可能生成90 g乙酸乙酯
难度: 中等查看答案及解析
-
常温下,下列各种情况下一定能大量共存的离子组为( )
A.
的溶液中:
B. 由水电离出的
的溶液中:
C.
的溶液中:
D. 无色溶液中:
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A. 羟基的电子式:
B. 乙酸的分子式:
C. 四氯化碳分子比例模型:
 D. 丙烷分子的比例模型:
D. 丙烷分子的比例模型: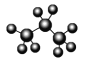
难度: 中等查看答案及解析
-
下列各组物质中,可以用分液漏斗分离的是
A.酒精与汽油 B.溴苯与溴乙烷 C.硝基苯与水 D.苯与硝基苯
难度: 简单查看答案及解析
-
准确移取
某待测
溶液于锥形瓶中,用
溶液滴定,下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,直接装入
溶液进行滴定
B. 随着
溶液滴入,锥形瓶中溶液
由小变大
C. 用甲基橙作指示剂
D. 滴定达終点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
下列有机物命名正确的是( )
A.
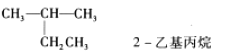 B.
B. 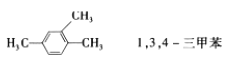
C.
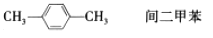 D.
D. 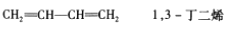
难度: 中等查看答案及解析
-
三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
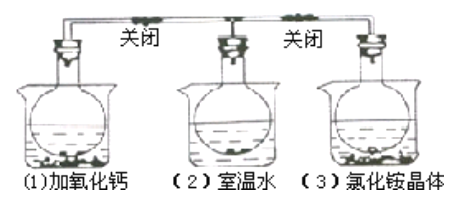
A. 2NO2
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
难度: 简单查看答案及解析
-
主链上含5个碳原子,有甲基、乙基2个支链的烷烃有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 困难查看答案及解析
-
分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 ( )
A. 红外光谱 B. 1H核磁共振谱 C. 质谱法 D. 与钠反应
难度: 简单查看答案及解析
-
在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
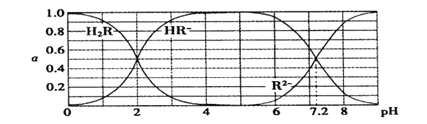
A. H2R是二元弱酸,其Ka1=1×10-2
B. 当溶液恰好呈中性时,c( Na+ )="2c" ( R2- ) + c( HR- )
C. NaHR在溶液中水解倾向大于电离倾向
D. 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
难度: 困难查看答案及解析
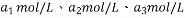 ,则它们的大小关系为_________________________________________。
,则它们的大小关系为_________________________________________。
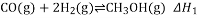
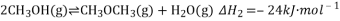
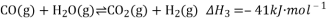
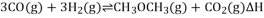 ,该反应
,该反应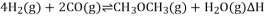 ,其
,其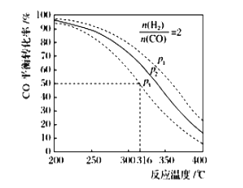
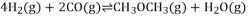 ,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数
,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数