-
下列对文中描述内容的相关解释正确的是( )
选项
描述
解铎
A
丹砂烧之成水银,积变又还成丹砂
两个反应互为可逆反应
B
凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之
其中“瓦”的主要成分为硅酸盐
C
硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起
产生“紫青烟”的原因为KNO3分解
D
其法用浓酒精和槽入瓶,蒸令气上,用器承滴露
其中涉及的操作方法为蒸发浓缩
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学与生活,生产密切相关,下列说法正确的是( )
A. 向燃煤中加入CaO、推广电动公交车均符合绿色化学理念
B. 市售“锌强化酱油”中含有大量锌元素
C. 银氨溶液常用于测定血液中葡萄糖的含量
D. 皂化反应用于制备高级脂肪酸和甘油
难度: 简单查看答案及解析
-
某有机物的结构简式如下所示,下列有关该有机物的说法不正确的是( )
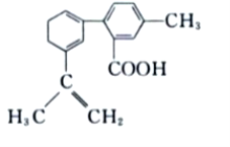
A. 苯环上的一氯代物有3种
B. 含有2种宫能团
C. 能发生氧化反应、取代反应、还原反应
D. 分子中的所有碳原子一定共面
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子半径依次增大,X是短周期元素中原子半径最小的,Z、W同主族,且Z、W的原子序数之差与Y的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法正确的是( )
A. Z单质与WYZ在高温条件下反应生成W单质,说明非金属性:Z>W
B. 向无色的X2Z2Y4溶液中滴加少量酸性高锰酸钾溶液,溶液仍为无色,体现了X2Z2Y4的还原性
C. Y、Z、W的简单氢化物的稳定性依次增强
D. 由X、Y两种元素形成的所冇化合物中所含化学键的类型完全相同
难度: 中等查看答案及解析
-
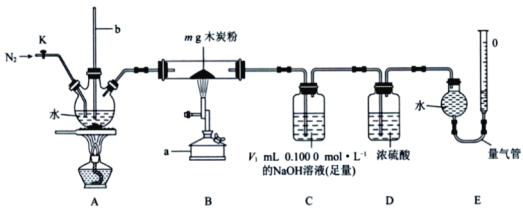
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
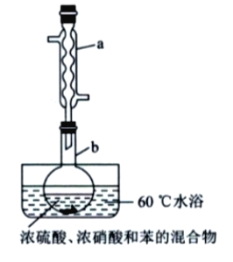
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
难度: 中等查看答案及解析
-
传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
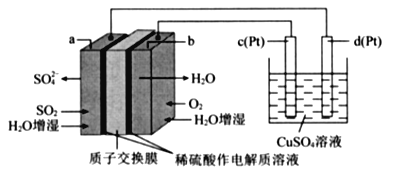
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
难度: 中等查看答案及解析
-
已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 mol•L-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
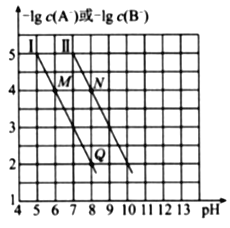
下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
难度: 中等查看答案及解析
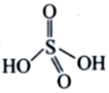 ,则H2S2O8的结构简式为 ________________。
,则H2S2O8的结构简式为 ________________。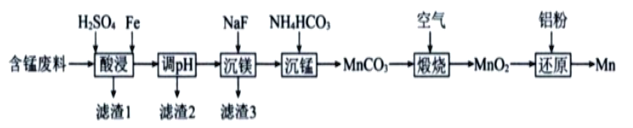

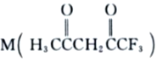 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含