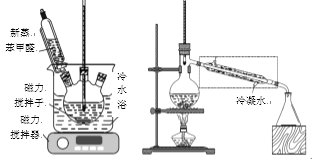
-
向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂
B. H2O2既表现氧化性又表现还原性
C. Cu2+将H2O2还原为O2
D. 发生了反应Cu2O + H2O2 + 4H+ == 2Cu2+ + 3H2O
难度: 中等查看答案及解析
-
根据元素周期律判断,不正确的是
A. 铍(Be)原子失电子能力比Ca弱 B. K与水反应比Mg与水反应剧烈
C. HCl的稳定性强于HBr D. 硼酸(H3BO3)的电离程度强于H2SO4
难度: 中等查看答案及解析
-
下列关于物质的组成、性质和用途的说法中,不正确的是
A
B
C
D
聚乙烯盒

带玻璃塞的试剂瓶

铁罐车

铝制饭盒

可用于盛装食品
可用于盛放氢氧化钠溶液
可用于运输浓硫酸
不宜长时间存放酸性或碱性的食物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)
O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A. 戴维法制钠,阳极的电极反应式为:Na++e-=Na↑
B. 盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C. 若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D. 还可以用电解熔融氯化钠法制钠
难度: 中等查看答案及解析
-
把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验
现象

①中溶液变蓝
②中溶液产生胶状沉淀
③中生成沉淀
④中产生黄绿色气体
下列分析不正确的是
A. ①中溶液变蓝,体现了浓盐酸的氧化性
B. ②中产生白色胶状沉淀:2H++SiO32-=H2SiO3
C. ③中产生沉淀的原因可用平衡移动原理解释
D. ④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O
难度: 中等查看答案及解析
-
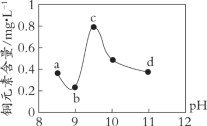
某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH-
[Cu(OH-)4]2-
项目
废水水质
排放标准
pH
1.0
6~9
Cu2+/ mg·L-1
72
≤0.5
NH4+/ mg·L-1
2632
≤15
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
难度: 中等查看答案及解析

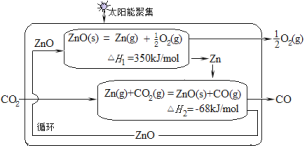
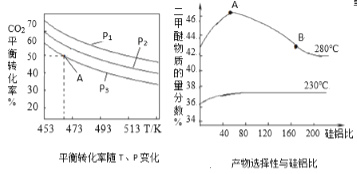
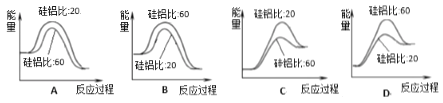
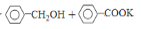 \
\