-
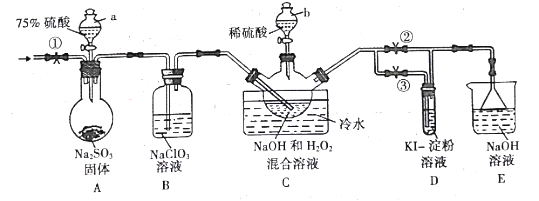
利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是
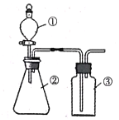
A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 4.6g金属钠与氧气完全反应,失去电子数目不一定为0.2NA
B. 25℃时,1LpH=4的NH4Cl溶液中,由水电离出的H+数目为10-4NA
C. 常温常压下,32gSO2与11.2L CO2所含的分子数目均为0.5N
D. 一定条件下,丁烷催化裂化生成1molC2H4时,消耗丁烷分子数目为NA
难度: 中等查看答案及解析
-
两个环共用两个不直接相连的碳原子的化合物称为桥环化合物,某桥环化合物的结构简式如图所示,下列关于该化合物的说法错误的是
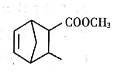
A. 该有机物能发生取代反应和加成反应
B. 该有机物分子中含有两个官能团
C. 该有机物分子的一氯代物有7种
D. 该有机物能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
现有M、N、P、Q四种短周期主族元素,其原子半径依次増大。M、N原子的最外层电子数相同,P、Q两原子与M、N两原子核内质子总数相等。N与Q形成的二元化合物其水溶液呈碱性。下列说法错误的是
A. 四种元素中,M的非金属性最强,Q的金属性最强
B. 由Q和M两种元素形成的化合物中一定只含有离子键
C. N、P、Q的最高价氧化物对应的水化物相互之间能发生反应
D. 四种元素形成的简单离子中,N的半径最大,P的半径最小
难度: 中等查看答案及解析
-
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是
A. 砷酸的分子式为H2AsO4
B. 红棕色气体在该原电池的负极区生成并逸出
C. 该反应的氧化剂和还原剂物质的量之比为12:1
D. 该反应中每析出4.8g硫黄,则转移0.5mol电子
难度: 中等查看答案及解析
-
常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lgKa。下列有关叙述错误的是

A. HA、HB两种酸中,HB的酸性弱于HA
B. b点时,c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—)
C. 同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D. 向HB溶液中加入NaOH溶液所得的混合溶液中
难度: 困难查看答案及解析