-
下列食品添加剂中,其使用目的与反应速率有关的是
A. 抗氧化剂 B. 调味剂 C. 着色剂 D. 增稠剂
难度: 简单查看答案及解析
-
下列分析不正确的是
A. “木与木相摩则然(燃)”的“然”是化学能转变为热能
B. “司烜氏,掌以夫遂(青铜凹镜)取明火于日”的“夫遂”是单质
C. “著作酒醴(甜酒),尔惟曲蘖(酒曲)”的“曲蘖”是催化剂
D. “浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是( )
A. 明矾作净水剂 B. 液氯作制冷剂
C. 溶洞的形成 D. 生石灰作干燥剂
难度: 简单查看答案及解析
-
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-.有关该电池的说法正确的是( )
A. Mg为电池的正极 B. 负极反应为AgCl+e-=Ag+Cl-
C. 该电池将潮汐能转化为电能 D. 可用于海上应急照明供电
难度: 中等查看答案及解析
-
某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是
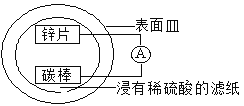
A. 锌片作正极
B. 碳棒上有气泡产生
C. 可将电能转化为化学能
D. 电子由碳棒经导线流向锌片
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A. 氢化物沸点:W<Z
B. 氧化物对应水化物的酸性:Y>W
C. 气态氢化物的稳定性:W>X
D. 简单离子的半径:Y<X
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A. 中子数为8的氮原子:87N B. 铁红的化学式为Fe3O4
C. NH3 的结构式:
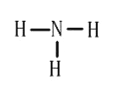 D. Cl-的结构示意图:
D. Cl-的结构示意图:难度: 简单查看答案及解析
-
下列关于碱金属元素和卤素的说法中,错误的是( )
A. 钾与水的反应比钠与水的反应更剧烈
B. 随核电荷数的增加,碱金属单质的密度逐渐变大
C. 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
D. 碱金属元素中,锂原子失去最外层电子的能力最弱
难度: 简单查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b-和c+的电子层结构相同,d与b同族.下列叙述错误的是( )
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. 气态氢化物稳定性:b>d
C. 简单离子半径:b->c+
D. d的最高价含氧酸是短周期元素最高价含氧酸中酸性最强的
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. I的原子半径大于Br,HI比HBr的酸性强
B. P的非金属性小于Si,H3PO4 比H2SiO3 的酸性弱
C. Al2O3 和MgO均可与NaOH溶液反应
D. 非金属性Cl>Br>I,沸点HCl>HBr>HI
难度: 中等查看答案及解析
-
化学反应速率受外界条件如反应温度、反应物浓度、压强、催化剂等的影响.烧烤时,用扇子向红热的木炭扇风,火会更旺,其原因是( )
A. 使O2浓度增加,反应加快 B. 温度降低,反应减慢
C. 使CO2 浓度增加,反应加快 D. 压强降低,反应减慢
难度: 简单查看答案及解析
-
把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )
① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
难度: 简单查看答案及解析
-
下列事实能说明Al的金属活动性比Cu强的是
A.常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中
B.常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中
C.与氯气反应时,铝失去3个电子,而铜失去2个电子
D.常温下,铝在浓硝酸中钝化而铜不发生钝化
难度: 中等查看答案及解析
-
下列事实能用电化学理论解释的是( )
①轮船水线以下的船壳上镶嵌有一定量的锌块
②镀锌的铁制品比镀锡的铁制品耐用
③铝片不用特殊方法保存
④常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应
A. ①④ B. ②③ C. ①② D. ②④
难度: 简单查看答案及解析
-
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O = ZnO+2MnOOH。下列说法不正确的是( )
A. 该电池Zn为负极
B. 该电池的正极反应为:MnO2 + e- + H2O = MnOOH + OH-
C. 外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D. 电池工作时水分子和OH-都能透过薄层纸片
难度: 中等查看答案及解析
-
下列电池工作时能量转化形式与其他三个不同的是( )




A.氢燃料电池
B.硅太阳能电池
C.银锌纽扣电池
D.碱性锌锰干电池
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 物质发生化学反应时都伴随能量变化,有能量变化的变化一定是化学变化
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 离子化合物中一定含有离子键,共价化合物中一定不含离子键
D. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
难度: 中等查看答案及解析
-
下列操作能达到实验目的的是( )
实验目的
实验操作
A
证明Cl的非金属性比C强
将盐酸滴入放有大理石的烧杯中,观察是否有气泡产生。
B
比较Mg与Al的金属性强弱
将镁条与铝片用导线相连,放入盛有NaOH溶液的烧杯中,观察现象。
C
证明增大反应物浓度,能加快化学反应速率
将两块表面积相同的锌粒分别放入稀硫酸和浓硫酸中。
D
证明KCl中存在离子键
熔融状态的KCl是否导电
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列表示的是化学反应A(g)+2B(g) = C(g)+D(g)在不同条件下的反应速率,其中最快的是( )
A. v(A) = 0.3 mol/(L·s) B. v(B) = 0.5 mol/(L·s)
C. v(C) = 0.4 mol/(L·min) D. v(D) = 0.2 mol/(L·s)
难度: 简单查看答案及解析
-
把下列四种盐酸溶液分别加入四个盛有20mL 1mol/L的KOH溶液的烧杯中,均加水稀释到100mL,此时反应最快的是( )
A. 20℃ 20mL 3mol/L的盐酸 B. 25℃ 30mL 2mol/L的盐酸
C. 25℃ 10mL 5mol/L的盐酸 D. 20℃ 10mL 2mol/L的盐酸
难度: 中等查看答案及解析
-
一定温度下用铁块与稀硫酸反应制取氢气,采取下列措施,①将铁块换成等质量的铁粉;②将稀硫酸换成浓硫酸;③加热;④加入少量KNO3固体;⑤加入适量CuSO4固体。其中能够加快氢气产生速率的是( )
A. ①③④ B. ②④⑤ C. ②③⑤ D. ①③⑤
难度: 中等查看答案及解析
-
下列反应条件的控制中不恰当的是( )
A. 为防止铁生锈,在其表面涂一层防锈油漆
B. 为防止火灾,在面粉厂要严禁烟火
C. 为加快KClO3的分解速率,加入MnO2
D. 为加快稀盐酸与NaOH的反应速率,加入更多同浓度的稀盐酸
难度: 简单查看答案及解析
-
一定温度下,向一恒容密闭容器中冲入2 mol SO2和1 mol O2,在一定条件下发生反应:2SO2+O2⇌2SO3,下列说法正确的是( )
A. 当O2浓度不变时,反应达到化学平衡
B. 达到化学平衡时,正反应和逆反应的速率都等于零,反应终止
C. 当单位时间内消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数之比为2:1:2时,反应达到平衡状态
难度: 中等查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气时放出能量121kJ,且氢气中1mol H-H键完全断裂时需要吸收能量436kJ,水蒸气中1mol H-O键形成时放出能量463kJ。则氧气中1mo O=O键断裂时吸收的能量为( )
A. 920 kJ B. 557 kJ C. 496 kJ D. 188 kJ
难度: 中等查看答案及解析