-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A. NaH的电子式为Na+[H]-
B. NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C. 微粒半径H-<Li+
D. NaH与H2O反应时,水作氧化剂
难度: 中等查看答案及解析
-
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a, c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是 ( )
A. b、a、e、d、c B. e、d、a、b、c
C. a、b、d、c、e D. c、d、e、a、b
难度: 简单查看答案及解析
-
金属钛对人体无毒且有惰性,能与肌肉和骨髓生长在一起,因而有“生物金属”之称。下列有关
和
的说法中不正确的是 ( )
A.
和
属于同种元素
B.
和
的性质几乎相同
C.
的相对原子质量约为48
D.
和
为不同的核素,互为同位素
难度: 简单查看答案及解析
-
已知元素R的某种核素的氯化物RClx中Rx+离子的核外电子数为z,核内中子数为y,则该核素的组成符号为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. Li是最活泼金属,F是最活泼非金属
B. Mg(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
难度: 中等查看答案及解析
-
在短周期元素中,A元素的最高正化合价和最低负化合价的绝对值之差为6,A元素与B元素可以形成化合物BA2,A的阴离子与B的阳离子具有相同的电子层结构,则该化合物是 ( )
A、MgCl2 B、CaCl2 C、SiO2 D、CS2
难度: 中等查看答案及解析
-
下列各组物质中化学键的类型相同的是( )
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. NH3 H2O CO2 D. CaCl2 NaOH H2O
难度: 中等查看答案及解析
-
下列化合物中,阳离子半径与阴离子半径比值最小的是
A. NaF B. NaCl C. MgI2 D. KBr
难度: 中等查看答案及解析
-
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B 的原子序数不可能为( )
A. n+8 B. n+18 C. n+32 D. n+20
难度: 中等查看答案及解析
-
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是 ( )
A. 原子半径:X>Y>Z>W B. 原子序数:Y>X>Z>W
C. 原子最外层电子数:Y>X>Z>W D. 金属性:X<Y,还原性:W2->Z-
难度: 中等查看答案及解析
-
下列关于化学键的说法中正确的是 ( )
A. 构成单质分子的微粒一定含有共价键
B. 非极性键只存在于双原子单质分子里
C. 由非金属组成的化合物不一定是共价化合物
D. 不同元素组成的多原子分子里的化学键一定都是极性键
难度: 中等查看答案及解析
-
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是 ( )
A. 由“Cl2+H2O===HCl+HClO”反应可推出“F2+H2O===HF+HFO”反应也能发生
B. HCl的水溶液是强酸,推出HF的水溶液也是强酸
C. 由“2Fe+3Cl2===2FeCl3”反应可推出“2Fe+3I2===2FeI3”反应也能发生
D. Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
难度: 中等查看答案及解析
-
根据下表信息,判断以下叙述正确的是 ( )
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的速率为L<Q
C. M与T形成的化合物具有两性 D. L2+与R2-的核外电子数相等
难度: 困难查看答案及解析
-
下列物质的电子式书写正确的是 ( )

A. ①②③④ B. ⑤⑥⑦⑧ C. ②③⑤⑥⑦ D. ①④⑧
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A. K3C60中只有离子键 B. K3C60中不含共价键
C. 该晶体在熔融状态下能导电 D. C60与12C互为同素异形体
难度: 中等查看答案及解析
-
如图为元素周期表前四周期一部分,且X、Y、Z、R和W为主族元素.下列说法中正确的是( )
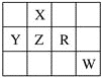
A. 五种元素一定都是非金属元素
B. 五种元素的原子最外层电子数一定都大于2
C. X的氢化物的稳定性比Z的氢化物的稳定性弱
D. R的最高价氧化物对应的水化物一定是强酸
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4
B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2
D. 热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析