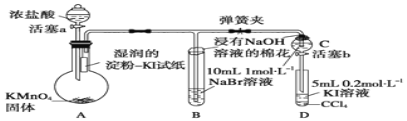
-
aR3-和bMn+的核外电子数相等,则a值等于
A. b+n-3 B. b+n-3 C. b-n+3 D. b-n-3
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.
中含有14个中子
B.
H、
H、
是同一种核素
C.
与
重水
互称同位素
D.
、
、金刚石、石墨均为碳的同素异形体
难度: 简单查看答案及解析
-
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
难度: 困难查看答案及解析
-
下列关于化学键的说法正确的是
①含有金属元素的化合物一定是离子化合物
②第ⅠA族和第ⅦA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
⑦非极性键只存在于双原子单质分子中
⑧不同元素组成的多原子分子中的化学键一定都为极性键
A. ①②⑤ B. ④⑤⑥ C. ①③④ D. ②③⑤
难度: 简单查看答案及解析
-
下列各组中的两种物质作用,反应条件或者反应物用量改变,不会引起产物种类改变的是()
A. Na和
B. NaOH和
C. Fe和
D.
和NaOH
难度: 中等查看答案及解析
-
下面是某同学所画的各原子的原子结构示意图,你认为正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.
的电子式:
B.
的结构示意图:
C. 中子数为20的氯原子:
D.
的电子式:
难度: 中等查看答案及解析
-
下列说法正确的( )
A. 含有共价键的化合物一定是共价化合物
B. 分子中只有共价键的化合物一定是共价化合物
C. 由共价键形成的一定是共价化合物分子
D. 只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
下列各组中化合物的性质比较,不正确的是
A. 稳定性:PH3>H2S> HCl B. 碱性:NaOH>Mg(OH)2>Al(OH)3
C. 酸性:HClO4>HBrO4>HIO4 D. 非金属性:F>O>S
难度: 困难查看答案及解析
-
下列微粒的半径比值大于1的是 ( )
A. Mg2+/Mg B. K+/S2- C. N/P D. Cl-/Cl
难度: 中等查看答案及解析
-
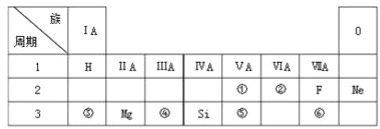
根据表中7种短周期元素的有关信息判断,下列说法错误的是
元素编号
原子半径
最高化合价或最低化合价
A. 元素
气态氢化物的稳定性大于元素
气态氢化物的稳定性
B. 元素
氢化物的沸点小于元素
氢化物的沸点
C. 元素
形成的化合物具有两性
D.
可形成离子化合物
难度: 简单查看答案及解析
-
把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )
① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
难度: 简单查看答案及解析
-
将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
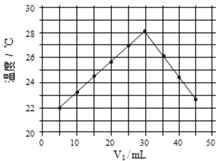
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
难度: 困难查看答案及解析
-
电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-= Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-= Ag+2OH—,总反应式为:Ag2O+H2O+ Zn= Zn(OH)2+ 2Ag下列说法不正确的是
A. 锌是负极,氧化银是正极
B. 锌发生氧化反应,氧化银发生还原反应
C. 溶液中OH-向正极移动,K+、H+向负极移动
D. 随着电极反应的不断进行,电解质溶液的pH会增大
难度: 简单查看答案及解析
-
下列有关电池叙述正确的是
A. 水果电池是高效环保的家用电池
B. 锌锰干电池是一种常用的二次电池
C. 锌锰干电池碳棒是负极,锌片是正极
D. 锌锰干电池工作一段时间后锌外壳逐渐变薄
难度: 简单查看答案及解析
-
下列图示的装置不属于原电池的是
A.
 B.
B. C.
D.
难度: 简单查看答案及解析