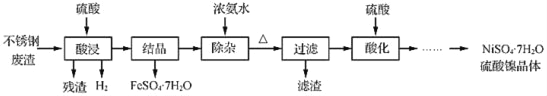
-
2019年1月3日,嫦娥四号成功着陆月球背面,搭载砷化镓太阳能电池的玉兔二号月球车开始了月球漫步。下列说法不正确的是( )
A. 太阳能是一种清洁、无污染的新能源
B. 砷化镓是制造太阳能电池的半导体材料
C. 砷化镓太阳能电池能将化学能转化为电能
D. 在元素周期表中金属元素与非金属元素的分界线附近可找到做半导体材料的元素
难度: 中等查看答案及解析
-
用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A. 中子数为8的氧原子:88O
B. NaOH的电子式:
C. H2O的结构式:
D. Na+的结构示意图:
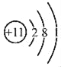
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. SiO2硬度大,可用于制作光导纤维
B. SO2具有氧化性,可用于漂白纸浆
C. Fe2O3能与酸反应,可用于制作红色涂料
D. Al(OH)3具有弱碱性,可用于制作胃酸中和剂
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1mol•L﹣1FeCl3溶液:Na+、ClO﹣、SO42﹣、SCN﹣
B. 0.1mol•L﹣1NaOH溶液:K+、NO3﹣、Br﹣、SiO32﹣
C. 0.1mol•L﹣1Ba(OH)2溶液:Al3+、NH4+、NO3﹣、HCO3﹣
D. 0.1mol•L﹣1KI溶液:Mg2+、NH4+、MnO4﹣、Cl﹣
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 向新制Cu(OH)2悬浊液中加入蔗糖溶液,加热,出现红色沉淀
B. 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,蛋白质变性,出现白色沉淀
C. 常温下,向浓硫酸中加入铁片,铁片溶解
D. 向FeCl3溶液中加入少量铜粉,铜粉溶解
难度: 中等查看答案及解析
-
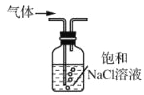
实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( )
A.
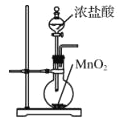 制取Cl2
制取Cl2B.
 除去Cl2中的少量HCl
除去Cl2中的少量HClC.
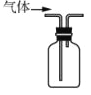 收集Cl2
收集Cl2D.
 吸收尾气中的Cl2
吸收尾气中的Cl2难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O⇌2H++Cl﹣+ClO﹣
B. 向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C. 向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D. 用铜做电极电解NaCl溶液:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y和Z的原子序数依次增大,W的阴离子核外电子数与X原子的内层电子数相同,X的一种核素在考古时常用来鉴定一些文物的年代,Y的单质在空气中的体积分数最大,Z是金属性最强的短周期元素。下列说法中正确的是( )
A. 原子半径:r(W)<r(X)<r(Y)<r(Z)
B. W、X、Y、Z原子的最外层电子数之和为10
C. W与X可形成含非极性键的化合物
D. X的最高价氧化物的水化物酸性比Y的强
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)
 NH3(g)
NH3(g)NH4Cl(aq)
B. Fe(s)
FeCl2(s)
Fe(OH)2(s)
C. MgO(s)
MgSO4(aq)
Mg(s)
D. S(s)
SO2(g)
BaSO3(s)
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
B. 可用牺牲阳极或外加电流的阴极保护法延缓钢铁水闸的腐蚀
C. Na2O2与水反应产生1molO2,理论上转移的电子数目约为4×6.02×1023
D. 保持温度不变,向稀氨水中缓慢通入CO2,溶液中c(OH-)/c(NH3·H2O )的值增大
难度: 中等查看答案及解析
-
有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
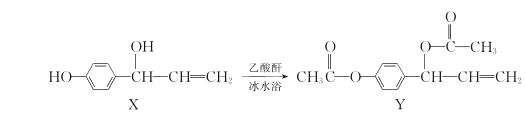
下列说法正确的是( )
A. X分子中所有原子一定在同一平面上
B. X、Y分子中均含有1个手性碳原子
C. 1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D. 1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为4mol
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.
 表示H2与O2发生反应过程中的能量变化,则H2O(g)═H2(g)+1/2O2(g)的△H=﹣241.8 kJ•mol﹣1
表示H2与O2发生反应过程中的能量变化,则H2O(g)═H2(g)+1/2O2(g)的△H=﹣241.8 kJ•mol﹣1B.
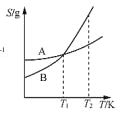 表示A、B两物质的溶解度随温度变化情况,将T1 K时A、B的饱和溶液分别升温至T2 K时,溶质的质量分数B>A
表示A、B两物质的溶解度随温度变化情况,将T1 K时A、B的饱和溶液分别升温至T2 K时,溶质的质量分数B>AC.
 表示镁条放入盐酸中生成氢气速率随时间的变化,0﹣t1反应速率加快的原因可能是该反应为放热反应
表示镁条放入盐酸中生成氢气速率随时间的变化,0﹣t1反应速率加快的原因可能是该反应为放热反应D.
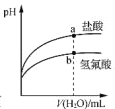 表示常温下稀释pH相同的氢氟酸与盐酸时溶液pH与加入水体积的关系,则氢氟酸为弱酸,且a点Kw的数值比b点的大
表示常温下稀释pH相同的氢氟酸与盐酸时溶液pH与加入水体积的关系,则氢氟酸为弱酸,且a点Kw的数值比b点的大难度: 中等查看答案及解析
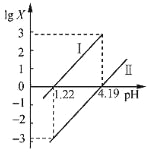


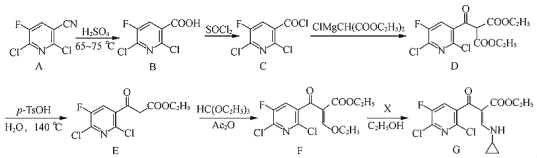
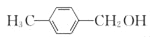 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备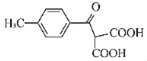 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。



 )中碳原子的杂化轨道类型为_____。
)中碳原子的杂化轨道类型为_____。 )分子中含有σ键的数目为_____mol。
)分子中含有σ键的数目为_____mol。