-
下列叙述中错误的是( )。
A.带相反电荷离子之间的相互吸引力称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间也可能形成离子键
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是( )
A. BF3 B. H2O C. SiCl4 D. PCl5
难度: 中等查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
难度: 中等查看答案及解析
-
下列关于元素的叙述正确的是
A. 金属元素与非金属元素能形成共价化合物
B. 只有在原子中,质子数才与核外电子数相等
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
难度: 中等查看答案及解析
-
放射性物质铱—192可使人的红细胞、白细胞、血小板严重偏低。则19277Ir中的中子数和质子数之差为( )
A. 115 B. 38 C. 269 D. 15
难度: 简单查看答案及解析
-
某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是( )
A. K2S B. MgS C. Na2O D. NaF
难度: 简单查看答案及解析
-
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有 ( )
A. 1对 B. 2对 C. 3对 D. 4对
难度: 中等查看答案及解析
-
无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是( )
A. 第15列元素的最高价氧化物的化学式是R2O3
B. 第1列和第17列元素单质熔、沸点变化趋势相反
C. 第11列中肯定没有非金属元素
D. 在18列元素中,第3列的元素种类最多
难度: 中等查看答案及解析
-
下列化合物的电子式书写正确的是( )
A.
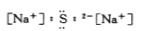 B.
B. 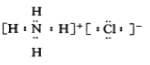 C.
C. D.
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是
A. 3种元素阴离子还原性按X、Y、Z的顺序增强
B. 单质的氧化性按X、Y、Z的顺序减弱
C. 气态氢化物的稳定性按X、Y、Z的顺序减弱
D. 原子半径按X、Y、Z的顺序减小
难度: 简单查看答案及解析
-
下列有关碱金属的叙述中,正确的是 ( )
A. 灼烧氯化钾时,火焰没有特殊颜色 B. 硝酸铷是离子化合物,易溶于水
C. 在钠、钾、铷三种单质中,铷的熔点最高 D. 氢氧化铷是弱碱
难度: 简单查看答案及解析
-
下表是元素周期表的一部分,有关说法正确的是( )
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
c
d
3
a
b
e
f
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的离子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
难度: 中等查看答案及解析
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A. 由mXa+与nYb-,得m+a=n-b
B. X2-的还原性一定大于Y-
C. X,Y一定不是同周期元素
D. 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
难度: 简单查看答案及解析
-
硼有两种天然同位素
B、
B,硼元素的近似相对原子质量为10.80,则对硼元素中
B的物质的量分数判断正确的是( )
A. 20% B. 略小于20% C. 略大于20% D. 80%
难度: 简单查看答案及解析
-
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
难度: 中等查看答案及解析
-
第七周期称为不完全周期,也可称为长周期,因这一周期元素也全部排满。则下列关于第七周期元素的推论可能错误的是 ( )
A. 第七周期排满时有32种元素
B. 第七周期排满时最后一种单质可能与其他物质发生化学反应
C. 原子序数为116号的元素位于第七周期第VIA族
D. 第七周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质
难度: 简单查看答案及解析