-
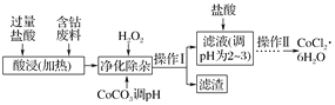
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
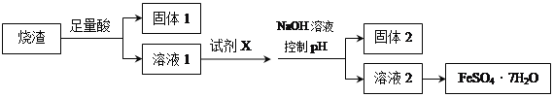
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
难度: 中等查看答案及解析
-
一种新药物结构如图所示,下列有关该化合物说法正确的是
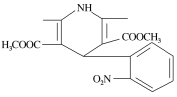
A. 分子式为C17H17N2O6
B. 能发生水解反应、聚合反应、取代反应
C. 能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
D. 分子中含有三种不同的官能团
难度: 中等查看答案及解析
-
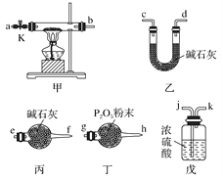
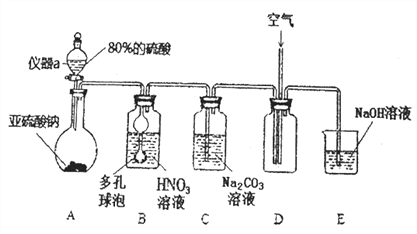
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.
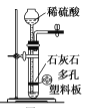 用于实验室制取少量CO2
用于实验室制取少量CO2B.
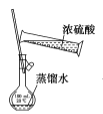 用于配制一定物质的量浓度的硫酸
用于配制一定物质的量浓度的硫酸C.
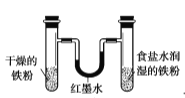 用于模拟生铁的电化学腐蚀
用于模拟生铁的电化学腐蚀D.
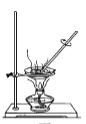 用于蒸干AlCl3溶液制备无水AlCl3
用于蒸干AlCl3溶液制备无水AlCl3难度: 中等查看答案及解析
-
如图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是( )
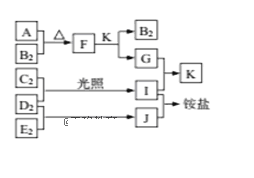
A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
难度: 困难查看答案及解析
-
某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是
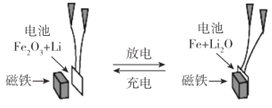
A. 放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe作电池的负极,Fe2O3作电池的正极
D. 充电时,电池被磁铁吸引
难度: 中等查看答案及解析
-
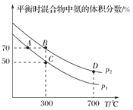
25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )
A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
难度: 困难查看答案及解析