-
下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:F->Cl->Br-
A. ①②④ B. ③④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
2018年是“2025中国制造”启动年,而化学与生活生产社会可持续发展密切相关。下列有关化学知识的说法错误的是( )
A. “玉兔二号”月球车底盘和车轮由SiC颗粒增强铝基复合材料制成,这是由于该复合材料具有重量轻、高刚度、高耐磨、耐冲击的特点
B. 我国发射的“北斗组网卫星”所使用的碳纤维,是一种非金属材料
C. 高纯二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. 钾一钠合金可用于原子反应堆的导热剂,钾与钠都属于短周期主族元素
难度: 简单查看答案及解析
-
由德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copemicium”,相应的元素符号为“Cn”,该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn 的过程可表示为:70Zn+208Pb═277Cn + 1n.下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. 得到Cn元素的相对原子质量为277
C. Cn元素位于元素周期表的第七周期,是副族元素
D.
的原子核内中子数比质子数多165
难度: 简单查看答案及解析
-
根据元素周期表判断下列描述正确的是( )
A. 元素周期表中,总共有16个纵行,16个族
B. 第IA族的元素又称为碱金属元素,第VIIA族的元素又称为卤族元素
C. 每个短周期都既包含金属元素也包含非金属元素
D. 在金属和非金属元素分界线附近可以寻找制作半导体材料的元素
难度: 中等查看答案及解析
-
下列各物质间关系描述准确的是( )
A. Na2O2和Na2O、红磷和白磷均属于同素异形体 B. 氕、氘、氚属于同一种元素
C. 金刚石和石墨是两种不同的核素 D. 146C和136C 、I2和I-都属于同位素
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 17 g OH- 含有的质子数为9NA
B. 2 L 0.5 mol·L-1 CH3COOH溶液中,CH3COO- 的数目为NA
C. 标准状况下,22.4 L HF含有的共价键数为NA
D. 2.0 g H218O与D2O的混合物中所含中子数为0.1NA
难度: 简单查看答案及解析
-
元素只有某种同位素的氯化物RClx, 已知该氯化物为离子化合物,在RClx中,R微粒核内中子数为Y,核外电子数为Z,则该同位素的符号为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤双原子分子组成的物质中一定存在非极性共价键
⑥熔融状态能导电的化合物是离子化合物
A. ②③④ B. ②④⑥ C. ①③⑥ D. ①③⑤
难度: 中等查看答案及解析
-
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4 高,则PH3 的熔沸点比NH3 高
B. Al(OH)3 能溶于NaOH 溶液,则Be(OH)2能溶于NaOH 溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2 即爆炸,I2在暗处遇H2 爆炸
难度: 中等查看答案及解析
-
对下列化学反应的热现象的说法不正确的是( )
①伴有能量变化的过程都是化学变化
②化学反应一定有能量变化,主要是由化学键变化引起的
③吸热反应需要加热后才能发生,放热反应不加热就会发生
④化学反应吸收或放出热量的多少与参加反应的物质的状态、质量有关
A. ①② B. ②③ C. ①③ D. ②④
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是( )
选项
实验操作
实验目的
A
F2、I2 分别与H2 反应
比较氟、碘的非金属性强弱
B
分别测定等浓度 H2SO4、H3PO4 和HClO3的pH
比较磷、硫、氯的非金属性强弱
C
向氯水中分别加入KI溶液、NaBr溶液
比较氯、溴、碘的非金属性强弱
D
向某溶液中加入盐酸,将生成的气体通入品红溶液中
检验溶液中是否含有SO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3﹣>D﹣>B+>A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,其中,W是最轻的金属。X与Y组成的化合物被称为“信息高速公路的骨架”,氢氟酸是唯一可以与之发生反应的酸。Z的最外层电子数为电子层数的2倍。下列说法正确的是( )
A. 单质的熔点:Z > X > Y
B. 简单氢化物的稳定性:X > Y
C. 金属W在空气中加热生成W2O2
D. W、Y的单质分别与氯气反应的产物所含的化学键类型相同
难度: 中等查看答案及解析
-
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种原子的原子核内中子的物质的量为
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl + NaOH = NaCl + NH3↑ + H2O B. Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑
C. Cl2 + 2NaOH = NaClO + NaCl + H2O D. 2Na2O2 + 2H2O = NaOH + O2↑
难度: 简单查看答案及解析
-
常温下,1 mol化学键断裂形成气态原子所需要的能量用
表示。结合表中信息判断下列说法不正确的是( )
共价键
H-H
F-F
H-F
H-Cl
H-I
E (kJ/mol)
436
157
568
432
298
A. 1 mol H2和1 mol F2完全反应时,释放25 kJ能量
B. 表中最稳定的共价键是H-F键
C. 1 mol H2转化为H原子时,吸收436 kJ能量
D. 432 kJ/mol > E (H-Br) > 298 kJ/mol
难度: 中等查看答案及解析
-
短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
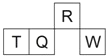
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含 T 的盐溶液一定能电离出 T 的阳离子
难度: 中等查看答案及解析
-
W、Q、X、Y、Z是五种短周期主族元素,其中X原子K、L层电子数之比为1∶2,Y元素最外层电子数是次外层的3倍,Z是短周期主族元素中原子半径最大的元素,W是地壳中含量最高的金属元素, Q元素最高化合价与最低化合价之和为6。下列判断正确的是
A. W、Q、X、Y、Z的原子序数依次递增
B. Y的简单氢化物比X的稳定性高
C. 常温下,W元素的单质与浓硝酸反应生成NO2
D. Z、W的单质分别与Q的单质化合后的产物中所含化学键类型相同
难度: 中等查看答案及解析
-
下列各组微粒:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O,具有相同质子数和电子数的是( )
A. ①②③ B. ①②④ C. ②③④ D. ①③④
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是放热反应的是( )
A. 氢氧化钠与稀硫酸的反应 B. 灼热的木炭与
的反应
C. 甲烷在空气中燃烧的反应 D. 氯酸钾受热分解
难度: 简单查看答案及解析
-
下列化学用语表述正确的是( )
A. 核内质子数为117、中子数为174的核素Ts可表示为:
B. 氯离子的结构示意图:
C. 次氯酸的结构式:H-O-Cl
D. CO2的电子式为:O::C::O
难度: 简单查看答案及解析
-
下表为短周期元素①~⑧的部分性质,下列说法正确的是( )
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/10-18m
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高化合价
+2
+1
+5
+7
+1
+5
+3
最低化合价
-2
-3
-1
-3
A. 元素①⑧形成的化合物具有两性
B. 元素④的最高价氧化物对应水化物的酸性比元素⑤的最高价氧化物对应水化物的酸性强
C. 元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
D. 上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
难度: 中等查看答案及解析
-
下列变化过程中,生成物总能量高于反应物总能量的化学反应是( )
A. 氧化钙溶于水 B. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
C. 铝粉与氧化铁粉末在高温下反应 D. NH4NO3 熔化为液态
难度: 中等查看答案及解析
-
下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A. 亚硫酸氢钠和硫酸分别溶解在水中 B. 硝酸铵与硝酸分别受热变为气体
C. 氯化钠与氯化氢分别溶解在水中 D. 碘与干冰分别受热变为气体
难度: 中等查看答案及解析
-
下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像
实验现象或图像信息
A

反应开始后,针筒活塞向右移动
B
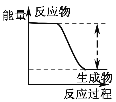
反应物总能量大于生成物总能量
C
反应开始后,甲处液面低于乙处液面
D
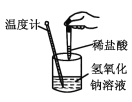
温度计的水银柱不断上升
A. A B. B C. C D. D
难度: 简单查看答案及解析