-
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0. 143
0.112
0. 104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的稳定性为H2T<H2R B. 单质与稀盐酸反应的剧烈程度为L<Q
C. M与T形成的化合物具有两性 D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素。X、Y最外层电子数之和与Z的最外层电子数相等;X、W在周期表中所处的周期数均等于其族序数;Y、Z相邻且Y的最低负价的绝对值与W的最高正价数值相等。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. Y的简单气态氢化物的热稳定性比Z的弱
C. X、Y、Z三种元素组成的化合物的水溶液一定能使石蕊溶液变红
D. W的氧化物只能与强酸反应,不能与强碱反应
难度: 中等查看答案及解析
-
短周期主族元素 W、 X、 Y、 Z 的原子序数依次增大,W的最外层电子数是内层电子数的3倍,X所在的周期数是最外层电子数的3倍,由 W、 X、 Y 三种元素形成的一种盐溶于水后,加入盐酸,产生的无色气体能使品红褪色。下列说法正确的是( )
A. W 与 X 可形成至少两种化合物
B. X 的简单离子与 Z 的简单离子具有相同的电子层结构
C. 最高价氧化物对应水化物的酸性: Y>Z
D. 简单气态氢化物的稳定性: W<Y
难度: 中等查看答案及解析
-
科学家最近发现两种粒子:第一种是由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法正确的是
A. “四中子”的粒子不显电性 B. “四中子”的电子数为4
C. 第二种粒子与O2互为同分异构体 D. 第二种粒子的晶体类型属于原子晶体
难度: 简单查看答案及解析
-
下列化学用语表示正确的是:
A. CO2分子的球棍模型:
 B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图:
C. CH4分子的比例模型:
D. 质子数为6,中子数为8 的核素:l4C
难度: 简单查看答案及解析
-
共价键、离子键和分子间作用力是微粒之间的不同作用力,下列物质中含有上述两种作用力的是
①NaOH ②SiO2 ③NH4Cl ④金刚石 ⑤NaCl ⑥干冰.
A. ①③⑥ B. ①②④ C. ②④⑤ D. ③④⑤
难度: 简单查看答案及解析
-
有5种微粒,它们分别是
、
、
、
、
,则它们所属元素的种类有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析
-
A,B属于短周期元素,能以化学键结合成AB3型的化合物,则AB元素不可能分别属于周期表中的( )
A. ⅠA,ⅦA B. ⅥA,ⅥA C. ⅢA,ⅦA D. ⅤA,ⅠA
难度: 简单查看答案及解析
-
砷为第4周期ⅤA族元素,根据它在元素周期表中位置推测,砷不可能具有的性质是
A. AsH3比NH3稳定 B. 可以存在-3、+3、+5等多种化合价
C. As2O5对应水化物的酸性比H3PO4弱 D. 砷的非金属性比磷弱
难度: 简单查看答案及解析
-
已知下列元素的原子半径:
元素
N
S
O
Si
原子半径/1010 m
0.75
1.02
0.74
1.17
根据以上数据,磷元素的原子半径可能是
A. 0.80×1010 m B. 1.10×1010 m
C. 1.20×1010 m D. 0.70×1010 m
难度: 简单查看答案及解析
-
某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断
A.R可能是第二周期元素
B.R一定是ⅥA族元素
C.R的气态氢化物比同周期其它元素气态氢化物稳定
D.R气态氢化物化学式为H2R
难度: 中等查看答案及解析
-
如图所示,在元素周期表中处于A、B位置的某些元素性质相似,这称为“对角线规则”。A为铍(Be),原子序数为4,B为铝(Al),下列有关其性质的推断正确的是
A. 铍能与冷水发生剧烈反应
B. 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C. 氢氧化铍的化学式为Be(OH)3
D. 氢氧化铍易溶于水
难度: 简单查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 简单查看答案及解析
-
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
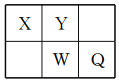
A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
难度: 中等查看答案及解析
-
下列有关叙述能说明非金属元素M比N的非金属性强的是
①非金属单质M能从N的化合物中置换出非金属单质N;②M原子比N原子容易得到到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物对应水化物的酸性HmMOx>HnNOy;⑥熔点M>N;⑦M原子在反应中得到的电子数比N原子在反应中得到的电子数少;⑧M的最高正价比N的最高正价高
A. ②⑤⑧ B. ①③⑤⑦ C. ①②③ D. 全部
难度: 中等查看答案及解析
-
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3 (ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
难度: 中等查看答案及解析