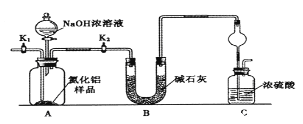
-
下列叙述正确的是
A. 常温常压下,4.6 gNO2气体约含有1.81×1023 个原子
B. 标准状况下,80gSO3所占的体积约为22.4 L
C. 标准状况下,22.4LCCl 4中含有的CCl4 分子数为NA
D. 标准状况下,22.4 L 氢气与足量氧气反应,转移的电子数为1NA
难度: 简单查看答案及解析
-
下列有关物质性质的比较顺序中,不正确的是
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaOH溶液:K+、Ba2+、Cl-、HCO3-
B. 0.1 mol·L-1Na2CO3溶液:K+、NH4+、NO3-、SO42-
C. 0.1 mol·L-1FeCl3溶液:K+、Na+、I-、SCN-
D. 0.1 mol·L-1HCl的溶液:Ca2+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
根据图中包含的信息分析,下列叙述正确的是( )
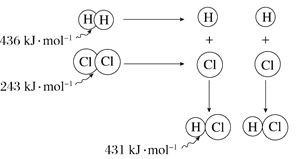
A. 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B. 436 kJ·mol-1是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C. 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D. 431 kJ·mol-1是指生成2 mol HCl中的H—Cl键需要放出431 kJ的能量
难度: 中等查看答案及解析
-
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案1:铝镁合金
测定生成的气体在标准状况下的体积
实验方案2:铝镁合金
测定生成的气体在标准状况下的体积
实验方案3:铝镁合金
溶液
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是
A. 都能 B. 都不能
C. ①不能,其它都能 D. ②③不能,①能
难度: 中等查看答案及解析
-
将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号
稀硝酸的体积/mL
剩余固体的质量/g
NO的体积/L
1
100
17.2
2.24
2
200
8.00
4.48
3
400
0
V
下列说法正确的是( )
A. 表中 V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L﹣1
难度: 困难查看答案及解析
-
下列实验中,对应的实验现象和实验结论都正确且具有因果关系的是
选项
实验方法或操作
实验现象
实验结论
A
将小块Na放入CuSO4溶液中
钠浮在水面上四处游动,溶液中有红色沉淀生成
金属Na比Cu活泼
B
在淀粉粉末中加入适量浓硫酸
淀粉变黑
浓硫酸具有吸水性
C
在AlCl3溶液中逐滴滴入NaOH溶液至过量,然后通入CO2气体
先出现白色沉淀,后沉淀消失,最后又出现白色沉淀
Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中
D
将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射
烧瓶内有气泡向上逸出
日光照射时,溶解的Cl2逸出
A. A B. B C. C D. D
难度: 中等查看答案及解析