-
[2017·新课标Ⅲ]砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________________________。
(3)已知:As(s)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+
O2(g)=H2O(l) ΔH2
2As(s)+
O2(g)=As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
(aq)+I2(aq)+2OH−(aq)
(aq)+2I−(aq)+ H2O(l)。溶液中c(
)与反应时间(t)的关系如图所示。
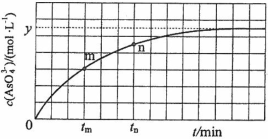
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I−)=2v(
)
c.c(
)/c(
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
难度: 中等查看答案及解析
-
[2017·新课标I]近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为______________、______________,制得等量H2所需能量较少的是_____________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率
_____
,该反应的
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
难度: 中等查看答案及解析
-
[2016·新课标I]元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、
(绿色)、
(橙红色)、
(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 。
(2)
和
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(
)随c(H+)的变化如图所示。
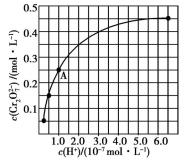
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增大,
的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③升高温度,溶液中
的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为___________mol·L−1,此时溶液中c(
)等于 mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的
还原成Cr3+,该反应的离子方程式为 。
难度: 中等查看答案及解析
-
[2016·新课标III]煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为 。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10−3 mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子
Cl−
c/(mol·L−1)
8.35×10−4
6.87×10−6
1.5×10−4
1.2×10−5
3.4×10−3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率 (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“增大”、“不变”或“减小”)。
③由实验结果可知,脱硫反应速率 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。
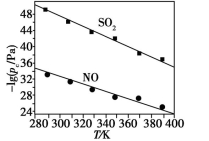
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均 (填“增大”、“不变”或“减小”)。
②反应
+2
2
+Cl−的平衡常数K表达式为 。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 。
②已知下列反应:
SO2(g)+2OH−(aq)
(aq)+H2O(l) ΔH1
ClO−(aq)+
(aq)
(aq)+Cl−(aq) ΔH2
CaSO4(s)
Ca2+(aq)+
(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO−(aq)+2OH−(aq)
CaSO4(s)+H2O(l)+Cl−(aq)的ΔH= 。
难度: 中等查看答案及解析