-
在一定温度下,可逆反应X(g)+3Y(g)═2Z(g)达到平衡的标志是( )
A.Z生成的速率与X消耗的速率相等
B.单位时间生成amolX,同时生成3amolY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1:3:2难度: 中等查看答案及解析
-
下述做法能改善空气质量的是( )
A.以煤等燃料作为主要生活燃料
B.鼓励私人购买和使用汽车代替公交车
C.利用太阳能、风能和氢能等能源替代化石能源
D.限制使用电动车难度: 中等查看答案及解析
-
微量元素硒(Se)对人体有保健作用,我国鄂西地区含有丰富的硒矿资源.已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )
A.硒的氢化物以H2Se形式存在
B.硒的氧化物以Se2O3形式存在
C.硒的氢化物的热稳定性比硫化氢差
D.硒的最高价氧化物的水化物的化学式是H2SeO4难度: 中等查看答案及解析
-
对于工业合成氨反应:N2+3H2⇌2NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100%
D.增大N2浓度可以增大反应速率难度: 中等查看答案及解析
-
2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.则下列有关说法不正确的是( )
A.高聚氮晶体属于分子晶体
B.高聚氮转化为N2是化学变化
C.高聚氮是N2的一种同素异形体
D.做炸药或高能材料可能是高聚氮潜在的应用难度: 中等查看答案及解析
-
氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化所克服的微粒间的作用力类型都相同的是( )
A.氯化钠和金刚石
B.金刚石和二氧化硅
C.冰和干冰
D.二氧化硫和二氧化硅难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.硫氰化钾溶液:Na+、Fe3+、Cl-、SO42-
B.常温下PH=1的溶液:Fe2+、Mg2+、NO3-、SO32-
C.无色透明溶液:Cu2+、Ag+、NO3-、Br-
D.氯化铵溶液:K+、H+、SO42-、NO3-难度: 中等查看答案及解析
-
同周期的X、Y、Z三种元素其最高价氧化物对应水化物均呈酸性,且酸性强弱顺序为HZO4>H2YO4>H3XO4.则下列推断中,正确的是( )
A.原子序数按X、Y、Z的顺序减小
B.单质的氧化性按X、Y、Z的顺序增强
C.原子半径按X、Y、Z的顺序增大
D.气态氢化物的稳定性按X、Y、Z的顺序减弱难度: 中等查看答案及解析
-
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构.以下关于A、B元素性质的比较中,正确的是( )
①原子序数:A>B ②离子半径:aAm+<bBn-
③原子半径:A<B ④元素所在的周期数:A>B
⑤A的最高正价与B的最低负价的绝对值相等 ⑥b=a+m-n.
A.②③④
B.①②④
C.④⑤⑥
D.②⑤⑥难度: 中等查看答案及解析
-
以下说法正确的是( )
A.金刚石和石墨可互称为同位素
B.D2和T2可互称为同素异形体
C.互为同分异构体
D.H和D是同素异形体难度: 中等查看答案及解析
-
下列反应或过程属于吸热的是( )
A.盐酸与NaOH溶液的反应
B.H+H=H2
C.Al和Fe2O3的铝热反应
D.Ba(OH)2.8H2O与NH4Cl反应难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数
B.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共18个纵行
C.除短周期外,其他周期均有18种元素
D.X2+的核外电子数目为18,则X在第三周期第ⅡA族难度: 中等查看答案及解析
-
下列实验方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶难度: 中等查看答案及解析
-
下列关于化学观或化学研究方法的叙述,错误的是( )
A.根据元素周期律,由HClO4可类推出氟元素也存在最高价氧化物的水化物HFO4
B.在元素周期表的金属和非金属分界线附近寻找半导体材料
C.控制实验条件可以改变可逆反应的限度和速率
D.在化工生产中应遵循“绿色化学”的思想难度: 中等查看答案及解析
-
关于卤素的下列叙述中正确的是( )
A.卤素是典型的非金属元素,因此不能与其它非金属元素化合
B.卤素单质越活泼,其熔、沸点越高
C.卤素各单质都能和水剧烈反应
D.卤素单质都能与H2化合难度: 中等查看答案及解析
-
实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )
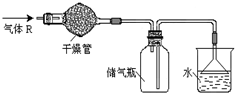
A.HCl
B.Cl2
C.CO
D.NH3难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法错误的是( )
A.常温常压下,16g由O2和O3组成的混合气体所含电子数为8NA
B.2g2H216O含有的共用电子对数目为0.2NA
C.常温常压下,11.2LH2中含有的电子数为NA
D.3molNO2与足量H2O反应,转移的电子数为2NA难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.NH4Cl固体与固体烧碱混合共热:NH4++OH-NH3↑+H2O
B.铜和稀硝酸的反应:Cu+4H++NO3-=Cu2++NO↑+2H2O
C.向氯化铁溶液中加入稀氨水:Fe3++3OH-=Fe(OH)3↓
D.Ba(OH)2和(NH4)2SO4溶液的混合加热:Ba2++2OH-+2NH4++SO42-BaSO4↓+2NH3↑+2H2O
难度: 中等查看答案及解析
-
下表给出几种氯化物与单质B的熔沸点,下列判断中正确的是( )
NaCl MgCl2 AlCl3 SiCl4 单质B 熔点(℃) 801 714 190 -70 2300 沸点(℃) 1413 1412 180 57 2500
A.SiCl4是原子晶体
B.单质B可能是原子晶体
C.AlCl3在加热时不能升华
D.NaCl比MgCl2更容易熔化难度: 中等查看答案及解析
-
下列关于制取硝酸铜的三种方案(原理)的叙述中,正确的是( )
①2Cu+O22CuO,CuO+2HNO3=Cu(NO3)2+H2O;
②3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O;
③Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
A.三方案中所涉及的反应都属于氧化还原反应
B.三方案中硝酸的利用率②>①>③
C.制取相同量的硝酸铜②产生的有害气体比③多
D.三种方案中①方案最优难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.吸热反应在不加热的条件下一定不能发生
B.放热反应在常温下一定很容易发生
C.由“C(石墨)=C(金刚石);△H=+119kJ/mol”知石墨比金刚石稳定
D.化学反应中的能量变化,只表现为热能的变化难度: 中等查看答案及解析
-
将0.1mol 铜与40mL 10mol•L-1HNO3充分反应后,溶液中含a mol H+,由此可知( )
A.生成的气体在标准状况下的体积为4.48L
B.生成的气体在标准状况下的体积为1.49L
C.被还原的硝酸的物质的量为(0.2-a)mol
D.反应后溶液中所含NO3-的物质的量为0.2mol难度: 中等查看答案及解析
-
反应:CO(g)+H2O (g)=CO2(g)+H2(g) 的能量变化如图所示,有关该反应的说法正确的是( )
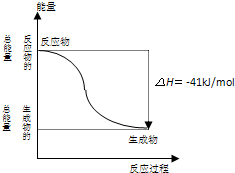
A.该反应为吸热反应
B.1molCO2(g)和1molH2(g)反应生成1molCO(g)和1molH2O(g)要放出41kJ热量
C.反应的热化学方程式是:CO(g)+H2O(g)=CO2(g)+H2(g)△H=+41kJ/mol
D.CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量难度: 中等查看答案及解析