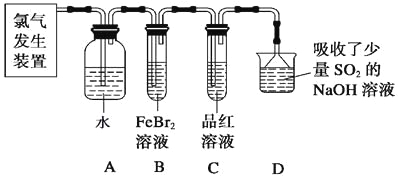
-
下列各组物质含有的化学键类型完全相同的是( )
A. HBr、 CO2、 NH3 B. Na2O、 Na2O2、 Na2S
C. NaCl、 HCl、 H2O D. NaOH、 CaCl2、 CaO
难度: 简单查看答案及解析
-
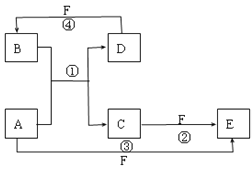
A、B、C、D为原子序数依次增大的短周期元素。已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物。化合物a~g的转化关系如图所示(部分产物己略去)。下列说法正确的是( )

A. 简单离子半径的大小:C>D>B
B. a中只含非极性共价键,属于共价化合物
C. B的氢化物的稳定性和沸点均大于A的氢化物
D. 工业上通过电解其氯化物的方法制取D的单质
难度: 中等查看答案及解析
-
下图中,表示正反应是吸热反应的是( )
A.
 B.
B. 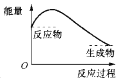 C.
C. 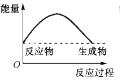 D.
D. 
难度: 简单查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )

①D 装置中纯Cu 电极反应为: Cu2++2e-=Cu
②整个电路中电子的流动方向为: ③→②; ①→⑧; ⑦→⑥;⑤→④;
③C 装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极, Ag作阳极
④A装置中C电极反应为: O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 淀粉、纤维素、蔗糖水解的最终产物都相同 B. 以淀粉为原料可制取乙酸乙酯
C. 糖类物质均可直接食用并能被人体吸收 D. 油脂都不能使溴水褪色
难度: 简单查看答案及解析
-
下列关于维生素C(
 )的说法错误的是( )
)的说法错误的是( )A. 维生素C 可以发生加成反应
B. 维生素C 可以与金属Na发生置换反应
C. 维生素C具有还原性,只能发生氧化反应
D. 维生素C 可以与NaOH 溶液发生取代反应.
难度: 中等查看答案及解析
-
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物.
A. ②⑤⑨ B. ①②⑤⑦⑨ C. ②④⑤⑥⑦⑨ D. 全部正确
难度: 中等查看答案及解析