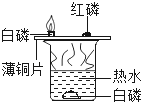
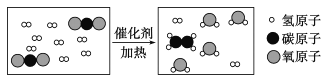
-
阅读下列短文,运用你所学的知识将符合题意的编号填入题后的空格里.
①氧气在通常情况下是无色无味的气体;
②氧气不易溶于水;
③在标准状况下氧气的密度是1.429g/L比空气重;
④将纯氧吹入炼钢炉中,可以提高炉温,用于炼钢;
⑤氧气在一定条件下能与铁丝、木炭等物质发生化学反应;
⑥氧气具有氧化性.其中属于物理性质的是_____,属于化学性质的是_____,属于用途的是_____.
难度: 简单查看答案及解析
-
依据所给内容:①2SO42﹣②氢气③二氧化硫④氢氧根离子⑤一氧化碳⑥N2 ⑦化石燃料之天然气的主要成份。按要求完成下列问题
(1)形成酸雨的主要气体_____;(用序号填空,下同)
(2)将成为一种重要的无污染新型燃料的是_____;
(3)其中的“2”表示离子个数的是_____;
(4)与血红蛋白结合引起中毒的气体_____;
(5)其中的“2”表示一个分子中的原子个数的是_____;
(6)写出氢氧化钠溶液中阴离子的符号_____(填写相应的化学用语,下同)
(7)天然气的主要成分的化学式_____。
难度: 简单查看答案及解析
-
美国普渡大学研究出一种利用铝镓合金制备氢气的新工艺,流程如图所示:

(1)氧化铝(Al2O3)制取铝的反应中。铝元素的化合价______(填“升高”“降低”“不变”);
(2)此流程生成的氧化铝中氧元素来自于___________;
(3)上述过程中,涉及到的氧化物有_____________(填化学式)
(4)氧化铝可以借助太阳能电池重新变成氧气与金属铝,该反应的化学方程式为__________________,反应类型是__________________(填“化合反应”或“分解反应”)。
难度: 中等查看答案及解析
-
已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成。其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如右图所示。
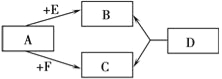
(1)则A、F的化学式为A:________________ ________________ ,F:________________________ ________________________
(2)请你写出下列变化的化学方程式:
A+E→B________________________________________________________________________________________________________________ ________________________________________________________________________________________________ ________________ ________
D→B+C ________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________
难度: 困难查看答案及解析
 B.
B.  C.
C.  D.
D.