-
下列分子均属于极性分子且中心原子均为sp3杂化的是 ( )
A. CH4、P4 B. SO2、CHCl3 C. PCl3、SO3 D. NH3、H2O
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4②ls22s22p63s23p3 ③ls22s22p3 ④ls22s22p5, 则下列有关比较中正确的是
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
下列离子中外层d轨道完全充满状态的是 ( )
A. Cr3+ B. Fe3+ C. Cu+ D. Co3+
难度: 中等查看答案及解析
-
已知NA为阿伏伽德罗常数的值.下列说法不正确的是 ( )
A. 1molCH4中含4NA个s﹣pσ键
B. 1molSiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 12g金刚石中平均含有2NA个σ键
难度: 中等查看答案及解析
-
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
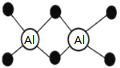
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
难度: 中等查看答案及解析
-
金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
难度: 中等查看答案及解析
-
下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是
A. CO2 B. H2O C. CO32﹣ D. CCl4
难度: 中等查看答案及解析
-
下图是氯化钠晶体和二氧化碳晶体的结构示意图关于两种晶体说法正确的是 ( )


A. 两种晶体均以分子间作用力按一定规则排列组成
B. 构成两种晶体的微粒均是原子
C. 两者的硬度、熔沸点等物理性质与微粒间的作用力都有密切关系
D. 两种晶体均属于离子晶体
难度: 中等查看答案及解析
-
在d轨道中电子排布成
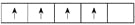 ,而不能排布成
,而不能排布成 ,其最直接的根据是( )
,其最直接的根据是( )A. 能量最低原理 B. 泡利原理 C. 原子轨道构造原理 D. 洪特规则
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A. 18gNH4+离子中所含的电子总数为12NA
B. 标准状况下,11.2L水含有的分子数为0.5NA
C. 0.3mol/LNa2SO4溶液中,含有Na+ 和 SO42- 总数为0.9NA
D. H2SO4的摩尔质量是98g/mol
难度: 中等查看答案及解析
-
下列各组物质中,化学键类型相同,晶体类型也相同的是 ( )
A. C(金刚石)和CO2 B. NaBr和HBr C. CH4和H2O D. Cl2和KCl
难度: 简单查看答案及解析
-
在体积相同的密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密毒相等时,下列说法中正确的是( )
A. 两种气体的压强相等 B. 两种气体的氧原子数相等
C. 两种气体的分子数目相等 D. O2比O3质量小
难度: 简单查看答案及解析
-
V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A. 通入标准状况下的HCl气体11.2V L
B. 加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C. 将溶液加热浓缩到0.5V L
D. 加入V L 1.5 mol·L-1的盐酸混合均匀
难度: 中等查看答案及解析
-
下列有关σ键和π键的说法错误的是( )
A. 在某些分子中,化学键可能只有π键而没有σ键
B. 当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键
C. σ键的特征是轴对称,π键的特征是镜面对称
D. 含有π键的分子在反应时,π键是化学反应的积极参与者
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、CCl4都是含有极性键的非极性分子
C. HF、HCl、HBr、HI的稳定性依次增强
D. CS2、H2O、C2H2都是直线型分子
难度: 中等查看答案及解析
-
现有四种晶体的晶胞,其离子排列方式如下图所示,其中化学式不属MN型的是( )
A.
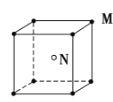 B.
B. 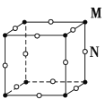 C.
C.  D.
D. 
难度: 简单查看答案及解析
-
实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为 ( )。
A. 950 mL;201.4 g B. 1 000 mL;212.0 g
C. 100 mL;21.2 g D. 500 mL;100.7 g
难度: 简单查看答案及解析
-
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是( )
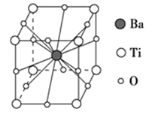
A. BaTi8O12 B. BaTi4O6 C. BaTi2O4 D. BaTiO3
难度: 中等查看答案及解析
-
下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是
A. ①② B. ①③ C. ④⑤ D. ②④
难度: 中等查看答案及解析
-
等物质的量浓度的KCl、MgCl2、AlCl3三种溶液。现欲完全沉淀其中的Cl—,消耗相同物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比为
A. 1:1:1 B. 9:3:1 C. 3:2:1 D. 9:3:2
难度: 中等查看答案及解析