-
下列说法正确的是( )
① H2O2 分子中既含极性键又含非极性键
② F2、Cl2、Br2、I2 熔点随相对分子质量增大而升高
③Na2O2 固体中的阴离子和阳离子个数比是 1∶2
④由于非金属性 Cl > Br > I,所以酸性 HCl > HBr > HI
A. ②③④ B. ①③④ C. ①②③ D. .①②③④
难度: 中等查看答案及解析
-
下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 二氧化硅是制造光导纤维的材料
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是( )
A. NH4Br的电子式:
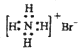 B. S的原子结构示意图:
B. S的原子结构示意图:C. 乙酸的分子式:CH3COOH D. 原子核内有18个中子的氯原子:
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
B. 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
C. 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
D. 向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,1 mol氦气含有的核外电子数为4NA
B. 17g NH3所含的氢原子数为3NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 2L 1mol/LNa2SO4溶液中含有的Na+的数目是2NA
难度: 简单查看答案及解析
-
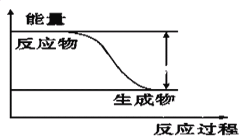
下列说法正确的是( )
A. 任何化学反应都伴随着能量的变化
B. H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化
C. 化学反应中能量的变化都表现为热量的变化
D. 对于如图所示的过程,是吸收能量的过程
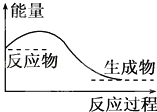
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. 可以用NaOH溶液鉴别MgCl2和AlCl3 B. 可以用溴水鉴别甲烷和乙烯
C. 可以用分液漏斗分离乙酸和乙醇 D. 可以用NaOH溶液除去苯中少量的Br2
难度: 简单查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
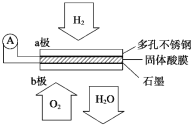
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
难度: 困难查看答案及解析
-
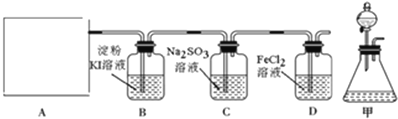
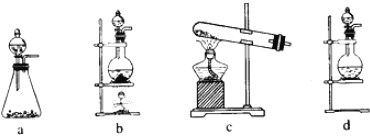
下列实验中,所选装置不合理的是
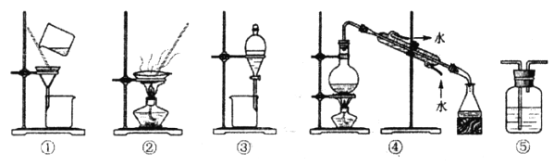
A. 分离Na2CO3溶液和CH3COOC2H5,选④ B. 粗盐提纯,选①和②
C. 用CCl4提取碘水中的碘,选③ D. 用FeCl2溶液吸收Cl2,选⑤
难度: 简单查看答案及解析
-
已知A、B、C、D为原子序数依次增大的短周期元素。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是( )
A. 最高价氧化物对应水化物的碱性:C>D B. 气态氢化物的稳定性:A>B
C. 四种元素能在同一周期 D. 原子半径:A>C
难度: 中等查看答案及解析
-
对于反应A(g)+B(g)
3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
A.
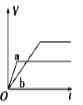 B.
B.  C.
C. 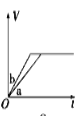 D.
D. 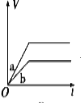
难度: 中等查看答案及解析
-
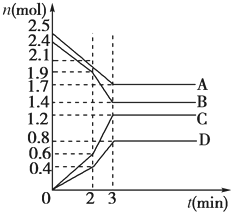
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )

A. 0~t2内用M表示的平均反应速率是2/t2(mol·L-1·min-1)
B. t1~t2内容器内的压强逐渐减小
C. 该反应的方程式为N
2M
D. t2与t3时刻的混合气体的平均相对分子质量相等
难度: 简单查看答案及解析