-
化学平衡移动原理在化T生产和科学研究中具有重要的指导作用,第一个提出平衡移动原理的科学家是( )
A.盖斯 B.勒·夏特列 C.门捷列夫 D.凯库勒
难度: 简单查看答案及解析
-
为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻我新能源。以下做法不能提高燃料效率的是( )
A.煤的汽化与液化 B.液体燃料呈雾状喷出
C.通人大大过量的空气 D.将煤粉碎后燃烧
难度: 简单查看答案及解析
-
反应A(g)+B(g)
C(g)+D(g)过程中的能量变化如图所示:下列说法正确的是( )
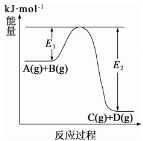
A.上述反应为吸热反应 B.上述反应的△H =E1kJ·mol-1
C.A(g)的能量一定大于C(g) D.反应物的总焓大于反应产物的总焓
难度: 中等查看答案及解析
-
下面是几种常见的化学电源,其中属于一次电池的是( )
A.干电池 B.铅蓄电池 C.燃料电池 D.锂离子电池
难度: 简单查看答案及解析
-
下列反应可能属于吸热反应的是( )
A.甲烷与氧气反应 B.碳酸钙分解反应
C.KOH与稀硫酸反应 D.铁丝与氯气反应
难度: 简单查看答案及解析
-
金属锡的冶炼常用焦炭作还原剂:SnO2+2C=Sn+2CO↑,反应过程中能量的变化如图所示。下列有关该反应的△H、△S的说法中正确的是( )
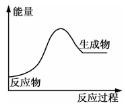
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
难度: 中等查看答案及解析
-
下列各项与反应热的大小无关的是( )
A.反应物的状态 B.反应物的多少 C.反应物的性质 D.反应的快慢
难度: 简单查看答案及解析
-
以下对影响反应方向的因素的判断错误的是( )
A.有时焓变起决定性作用 B.有时熵变起决定性作用
C.焓变和熵变是两个主要因素 D.温度不可能对反应方向起决定性作用
难度: 中等查看答案及解析
-
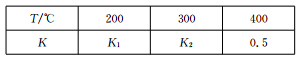
下列关于平衡常数K与化学平衡移动的关系叙述正确的是( )
A.K值不变,平衡不会移动 B.K值变化,平衡一定移动
C.平衡移动,K值一定变化 D.平衡移动,K值一定不变
难度: 中等查看答案及解析
-
如图所示铜锌原电池T作时,下列叙述不正确的是( )
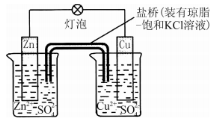
A.负极反应为:2n-2e -=2n2+ B.电池反应为:Zn+Cu2+=Zn2++Cu
C.盐桥中酌K+移向ZnSO4溶液 D.在外电路中,电子从负极流向正极
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.工业合成氨时采用铁触媒作反应的催化剂
C.工业生产硫酸的过程中使用过量的空气以提高SO2的转化率
D.将收集NO2气体的烧瓶密闭后放在装有热水的烧杯中,发生颜色变化
难度: 中等查看答案及解析
-
对外加电流的金属保护中,被保护的金属( )
A.与电源的正极相连 B.表面上发生氧化反应
C.与电源的负极相连 D.与另一种活泼性较差的金属相连
难度: 中等查看答案及解析
-
将a、b、c、d4种金属两两连接浸入电解质溶液中,组成4个如图原电池:
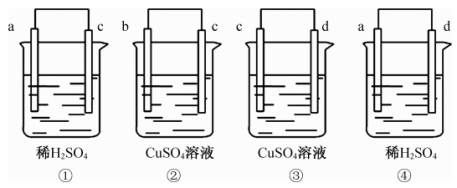
已知:①中a极发生氧化反应;②中电流由b到c;③中c极质量增加;④中a极有大量气泡。则4种金属的活泼性由强到弱的顺序为
A.d>a>c>b B.d>c>a>b C.b>d>c>a D.a>d>b>c
难度: 困难查看答案及解析
-
用惰性电极电解足量的下列溶液,一段时间后停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A.CuCl2( H2O) B. NaOH(Na2O) C.CuSO4( CuO) D. NaCl( NaOH)
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A.化学反应中,物质变化的同时不一定发生能量变化
B.反应焓变(△H)的大小与方程式中各物质的化学计量系数无关
C.反应产物的总焓大于反应物的总焓时,反应吸热,△H>0
D.吸热反应中,形成化学键释放的能量大于断裂化学键吸收的能量
难度: 中等查看答案及解析
-
已知:H2(g)+1/2O2(g)=H2O(g) △H=akJ·mol-l
2H2(g)+O2(g)=2H2O(g) △H=bkJ·mol-l
H2(g)+1/2O2(g)=H2O(1) △H=ckJ·mol-l
2H2(g)+O2(g)=2H2O(1) △H=dkJ·mol-l
下列关系式中正确的是
A. a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 中等查看答案及解析
-
氯碱工业是以电解饱和食盐水为基础的工业。饱和食盐水是以含Ca2+、Mg2+、SO42-、Fe3+等杂质离子的粗盐水精制,需要使用的药品包括:①稀盐酸 ②烧碱溶液 ③碳酸钠溶液 ④氯化钡溶液。下列有关说法不正确的是( )
A.加入烧碱溶液主要是除去Mg2+、Fe3+
B.药品加入的先后顺序可以是②③④①
C.加入稀盐酸主要是除去所加过量物质中的OH-、CO32-
D.加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+
难度: 困难查看答案及解析
-
一定条件下,将TiO2和焦炭放入密闭真空容器中,反应TiO2 (s)+C(s)
Ti(s)+CO2 (g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法一定正确的是( )
A.平衡常数减小 B.TiO2的质量不变
C.CO2的浓度不变 D.Ti的质量增加
难度: 中等查看答案及解析
-
在某温度下,可逆反应mA+nB
pC+qD的平衡常数为K,下列说法正确的是( )
A.K随压强的改变而改变 B.K越大,C的平衡浓度越小
C.C的起始浓度越大,K值越大 D.K越大,反应进行的程度越大
难度: 中等查看答案及解析
-
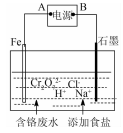
现有200 mL含KNO3和Cu(NO3)2的混合溶液,其中c(NO3- )=3 mol·L-l,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2. 24 L气体(标准状况)。假定电解后溶液体积仍为200 mL),下列说法不正确的是( )
A.电解过程中共转移0.4 mol电子 B.原混合液中c(K+)为2.0 mol·L-l
C.电解得到的Cu的质量为6.4 g D.电解后溶液中c(H+)为0.1 mol·L-l
难度: 极难查看答案及解析