-
下列有关元素化合物的叙述中正确的是( )
A.碱金属原子的最外层电子数都是1,次外层电子数都是8
B.将SO2通入滴有紫色石蕊试液的水中,溶液变成红色
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.高性能通信材料光 导纤维的主要原料是单品硅难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO2-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓
B.铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.向1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O难度: 中等查看答案及解析
-
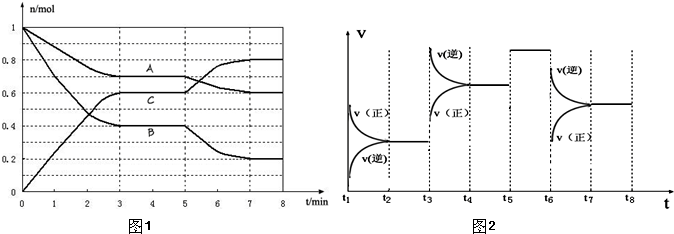
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2HI(g)⇌I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L.改变相关条件,下列结论正确的是( )
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%难度: 中等查看答案及解析
-
化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室 进行实验验证,
他们设计组装了如图所示装置,已知a为石墨电极;b为铁电极;c为铝电极(已除去表面氧化膜);d为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转.下列判断正确的是( )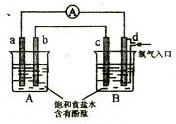
A.b为负极,d为阳极
B.一段时间后,a和d电极附近溶液变红
C.b电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失难度: 中等查看答案及解析
-
在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)( )
A.配制500mL 1mol/L稀硫酸实验中,用量筒量取18.1mol/L浓硫酸时俯视读数
B.配制1mL 5.1mol/L氯化钠溶液实验中,定容时仰视
C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数难度: 中等查看答案及解析
-
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol/L
C.pH=3的NaHA水溶液中,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为( )
A.75%
B.25%
C.88%
D.32%难度: 中等查看答案及解析